题目内容
4.Zn+H2SO4═ZnSO4 +H2 ↑,被氧化的元素是Zn,发生氧化反应的元素是Zn,被还原的元素是H,发生还原反应的元素是H,氧化剂是H2SO4,还原剂是Zn,H2SO4具有氧化性,Zn具有还原性.分析 Zn+H2SO4═ZnSO4 +H2↑中,Zn元素的化合价由0升高为+2价,H元素的化合价由+1价降低为0,以此来解答.
解答 解:Zn+H2SO4═ZnSO4 +H2↑中,Zn元素的化合价由0升高为+2价,失去电子被氧化,发生氧化反应,则Zn具有还原性,作还原剂;
H元素的化合价由+1价降低为0,得到电子被还原,发生还原反应,则H2SO4为氧化剂,具有氧化性,
故答案为:Zn;Zn;H;H;H2SO4;Zn;H2SO4;Zn.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意氧化还原反应基本概念,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
15.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),向甲溶液中加入淀粉溶液和氯水,则溶液变为黄色,再加入丙溶液,颜色颜色变蓝,则甲、乙、丙依次含有的卤素离子有( )
| A. | Br-、Cl-、I- | B. | Cl-、I-、Br- | C. | I-、Br-、Cl- | D. | Br-、I-、Cl- |
19.下列各组中的两种溶液:①氢氧化钠、硫酸铁;②稀硫酸、澄清石灰水;③氯化钠、硝酸银;④盐酸、四烃基合铝酸钠;⑤氯化铝、氢氧化钠;⑥碳酸钠、稀盐酸;⑦硝酸银、氨水 不需另加其他试剂,只需两两混合即可鉴别的是( )
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
20.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子.
③Z元素的电离能(用符号I表示)数据见表(kJ•mol-1)
请回答:
(1)Z2Y中含有的化学键类型为离子键.
(2)Z2Y2的电子式为 .
.
(3)X2Y分子的空间构型为V形,其中心原子的杂化方式为sp3,XWY属于极性(填“极性”或“非极性”)分子.
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的.
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子.
③Z元素的电离能(用符号I表示)数据见表(kJ•mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
(1)Z2Y中含有的化学键类型为离子键.
(2)Z2Y2的电子式为
 .
.(3)X2Y分子的空间构型为V形,其中心原子的杂化方式为sp3,XWY属于极性(填“极性”或“非极性”)分子.
1.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 60g丙醇中存在的共价键总数为10NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3-溶液中HCO3-和CO32-离子数之和为0.1NA |
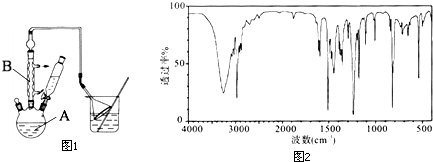
 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯(CH3)3CCl等为原料制备对叔丁基苯酚.实验步骤如下: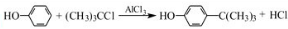 .该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应为放热反应,且实验的产率通常较低,可能的原因是由于叔丁基氯挥发导致产率降低.