题目内容
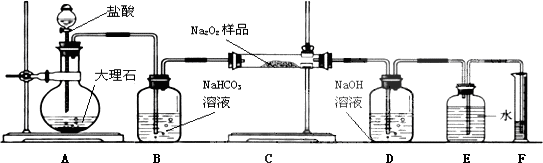
5.金属制品进行抗腐蚀处理,可延长其使用寿命.(1)以下为铝材表面处理的一种方法流程:
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO+3H2↑(用离子方程式表示).为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的b.
a.NH3 b.CO2 c.NaOH d.HNO
②其中,流程中以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,则阳极电极反应式为2Al+3H2O-6e-═Al2O3+6H+取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是Al3++3HCO3-═Al(OH)3↓+3CO2↑(用离子方程式表示)
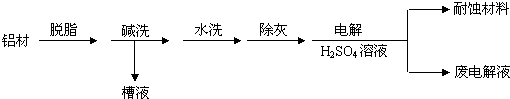
(2)利用如图装置,可以模拟铁的电化学防护.

①若X为锌,P为海水,开关K置于M处,该电化学防护法称为牺牲阳极保护法.
②若X为碳棒,P为海水,为减缓铁的腐蚀,开关K应该置于N处.
③若开关K置于N处,在铁上镀锌,则电极X材料为Zn,阴极电极反应为Zn2++2e-=Zn.
分析 (1)①有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或
CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)①若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法);
②根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;
③铁上镀锌,铁为阴极,锌为阳极,据此判断.
解答 解:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO+3H2↑;b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-═Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于废电解液中含有Al3+,和HCO3-发生了互促水解.或HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀,
故答案为:2Al+3H2O-6e-═Al2O3+6H+; Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(2)②金属的防护有牺牲阳极保法和外加电源阴极保护法,若K置于N处,必须让被保护的金属接电源负极;
①若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法),故答案为:牺牲阳极保护法;
②金属的防护有牺牲阳极保法和外加电源阴极保护法,若K置于N处,必须让被保护的金属接电源负极; 故答案为:N;
③铁上镀锌,铁为阴极,锌为阳极,所以电极X材料为Zn,阴极电极反应为Zn2++2e-=Zn,故答案为:Zn;Zn2++2e-=Zn.
点评 本题考查金属的性质、盐类的水解、电解、电镀以及金属的腐蚀及防护知识,考查较为综合,做题时注意把握好Al、AlO2-、Al(OH)3等物质的性质,掌握电解、电镀等知识的原理,了解金属的防护措施,难度不大,但要注意知识的积累,厚积而薄发.

| A. | 盐 胆矾 KAl(SO4)2•12H2O | B. | 碱 纯碱 Na2CO3 | ||
| C. | 金属氧化物 氧化铜 CuO | D. | 无机化合物 醋酸 CH3COOH |
 表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题: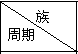 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | ⑧ |
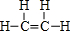 ,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.
,该物质与溴水发生加成反应的化学方程式是CH2=CH2+Br2→BrCH2CH2Br.(2)用电子式表示④的简单氢化物的形成过程
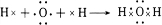
(3)用①元素的单质与④元素的单质可以制成原电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:H2-2e-+2OH-=2H2O
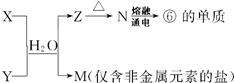
(4)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生(如图)反应:
X溶液与Y溶液反应的离子方程式为Al3++3NH3.3H2O=Al(OH)3↓+3NH4+,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
| A. | Fe3+ Na+ S2- Cl- | B. | Al3+ NH4+ AlO2- NO3- | ||
| C. | NH4+ Mg2+ SO42- Cl- | D. | H+ Na+ HCO3- SiO32- |
| A. | Br-、Cl-、I- | B. | Cl-、I-、Br- | C. | I-、Br-、Cl- | D. | Br-、I-、Cl- |