题目内容
10.完全沉淀等体积、等物质的量浓度的AgNO3溶液,需要加入等浓度的NaCl、MgCl2、AlCl3溶液的体积之比为( )| A. | 1:1:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
分析 可溶性氯化物和AgNO3溶液反应离子方程式为Ag++Cl-=AgCl↓,完全沉淀等体积、等物质的量浓度的AgNO3溶液,则消耗n(Cl-)相等,根据n=CV及化学式中氯离子个数计算需要三种盐溶液体积.
解答 解:可溶性氯化物和AgNO3溶液反应离子方程式为Ag++Cl-=AgCl↓,完全沉淀等体积、等物质的量浓度的AgNO3溶液,则消耗n(Cl-)相等,NaCl、MgCl2、AlCl3溶液的物质的量浓度相等,根据n=CV及化学式知,需要三种盐溶液体积之比=$\frac{n(C{l}^{-})}{1}$:$\frac{n(C{l}^{-})}{2}$:$\frac{n(C{l}^{-})}{3}$=6:3:2,故选C.
点评 本题考查化学方程式有关计算,为高频考点,可以利用方程式计算也可以利用关系式计算,明确所需氯离子的物质的量相等是解本题关键,题目难度不大.

练习册系列答案
相关题目
1.下列反应的离子方程式书写不正确的是( )
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 硫化钠的水解:S2-+H2O?HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
18.一定条件下,分别以KMnO4、KClO3、H2O2、HgO(HgO分解产生O2)为原料制取O2.当制得同温、同压下相同体积的O2时,四个反应中转移的电子数之比是( )
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
15.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),向甲溶液中加入淀粉溶液和氯水,则溶液变为黄色,再加入丙溶液,颜色颜色变蓝,则甲、乙、丙依次含有的卤素离子有( )
| A. | Br-、Cl-、I- | B. | Cl-、I-、Br- | C. | I-、Br-、Cl- | D. | Br-、I-、Cl- |
2.能正确表示下列反应的离子方程式是( )
| A. | 用石墨作电极电解氯化镁溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$-H2↑+Cl2↑+2OH- | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2=2NH4++SO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
19.下列各组中的两种溶液:①氢氧化钠、硫酸铁;②稀硫酸、澄清石灰水;③氯化钠、硝酸银;④盐酸、四烃基合铝酸钠;⑤氯化铝、氢氧化钠;⑥碳酸钠、稀盐酸;⑦硝酸银、氨水 不需另加其他试剂,只需两两混合即可鉴别的是( )
| A. | ④⑤⑥⑦ | B. | ①②③④⑤⑥ | C. | ①③④⑤ | D. | 全部 |
7.(一)按要求作答:
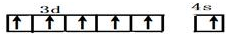
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:3d54s1.
(2)3d能级为半充满的正三价离子,该离子的电子排布式为1s22s22p63s23p63d5.
(二)A、B、C、D、E五种元素为1~18号元素.已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30.它们两两形成的化合物有甲、乙、丙、丁四种.这四种化合物中原子个数比如下表:
(1)E-的结构示意图是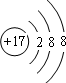 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为CH2=CH2.
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:3d54s1.
(2)3d能级为半充满的正三价离子,该离子的电子排布式为1s22s22p63s23p63d5.
(二)A、B、C、D、E五种元素为1~18号元素.已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30.它们两两形成的化合物有甲、乙、丙、丁四种.这四种化合物中原子个数比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:2 | D和E 1:3 | B和E 1:4 |
 .B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).
.B原子核外有2个未成对电子,它们的能量相等(填“相等”或“不相等”).(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为CH2=CH2.
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是Al3++3HCO3-=Al(OH)3↓+3CO2↑.
 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族