题目内容
17.常温下,下列事实可证明氨水是弱碱的是( )| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 0.1mol/L氯化铵溶液的pH约为5 | |
| C. | 0.1mol/L氨水可以使酚酞试液变红 | |
| D. | 铵盐受热易分解 |
分析 只要说明一水合氨在水溶液中部分电离就能证明一水合氨是弱碱,可以根据一定浓度溶液的pH、强酸铵盐的酸碱性等分析判断.
解答 解:A.氨水和氯化亚铁反应生成氢氧化亚铁沉淀,说明一水合氨是碱,但不能水解一水合氨部分电离,所以不能说明是弱电解质,故A错误;
B.常温下,0.1mol/L的氯化铵溶液pH约为5,溶液呈酸性,说明氯化铵是强酸弱碱盐,则说明一水合氨是弱电解质,故B正确;
C.0.1mol/L氨水可以使酚酞试液变红,说明一水合氨是碱,但不能说明一水合氨部分电离,所以不能说明一水合氨是弱电解质,故C错误;
D.铵盐受热易分解说明铵盐不稳定,不能说明一水合氨部分电离,则不能说明一水合氨是弱电解质,故D错误;
故选B.
点评 本题考查弱电解质的判断,明确强弱电解质的根本区别是解本题关键,注意不能根据溶解性强弱、溶液导电能力大小判断电解质强弱,为易错点.

练习册系列答案
相关题目
7.已知短周期元素的离子aA2+、bB+、cC2?、dD?都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
8.(1)向一定体积的密闭容器中加入2molA、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图I所示,其中t0~t1阶段c(B)画出.图Ⅱ为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
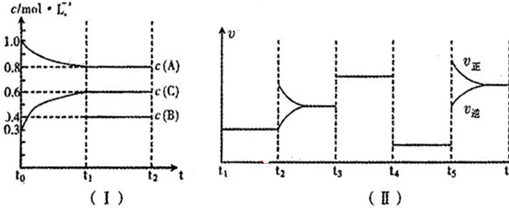
请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”、“<”或“=”连接);
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g) 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol
(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.

请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
5.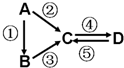 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )| A. | 若A是单质,C、D是氧化物,且D能与水反应生成强酸,则A一定是硫 | |
| B. | 若A是一种淡黄色固体,①②反应都有共同的单质生成,则A中阳阴离子个数比为1:1 | |
| C. | 若A物质具有两性,D为白色沉淀,则反应④的转化通入二氧化碳或氨气都能实现 | |
| D. | 若A是应用最广泛的金属,且A与C反应生成D,则②⑤反应的另一反应物一定是Cl2 |
12.一定能在下列溶液中大量共存的离子组是( )
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、C1-、HCO3- | |
| B. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| C. | 能使pH试纸变蓝色的溶液:Na+、S2-、CO32-、AlO2- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、A13+、SO42- |
9.化学与生活、生产、环境等密切相关.下列说法错误的是( )
| A. | 煤的液化、石油的裂化和油脂的皂化都属于化学变化 | |
| B. | 糖、油脂和蛋白质都是人体生命活动所需的基本营养物质 | |
| C. | 静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量 | |
| D. | 硝酸纤维、聚酯纤维和光导纤维都可由纤维素在一定条件下制得 |
6.乙烷与氯气在光照条件先发生取代反应所得有机产物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
7.元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
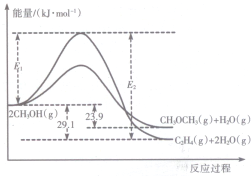 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应: