题目内容
10.下列实验能实现的是( )①加热蒸干硫酸铝溶液并灼烧以制得硫酸铝固体;
②加热蒸干氯化铝溶液并灼烧以制得氧化铝固体;
③用湿润的pH试纸来测定碳酸钠溶液的pH;
④用pH相同的两种酸与锌反应,由开始时的反应速率来比较这两种酸的相对强弱;
⑤盛放待测液的锥形瓶先用待测液润洗,而后再注入待测液进行滴定以测待测液的浓度.
| A. | ①② | B. | ①⑤ | C. | ②⑤ | D. | ①②⑤ |
分析 加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况,
①加入硫酸铝溶液,虽然铝离子水解生成氢氧化铝,但硫酸难挥发,最终仍为硫酸铝;
②氯化铝易水解,加热HCl挥发,水解彻底进行得到氢氧化铝,灼烧氢氧化铝分解;
③PH试纸湿润相当与稀释待测液,测量pH值不准确;
④用pH相同的两种酸与锌反应,起始时,溶液中氢离子浓度相同,反应速率相同,不能判断酸性强弱;
⑤锥形瓶用待测液润洗,待测液的物质的量增多.
解答 解:①硫酸铝溶液中铝离子水解生成氢氧化铝和硫酸,硫酸是难挥发性酸,加热蒸干硫酸铝溶液并灼烧蒸发水,得到固体为硫酸铝,故①正确;
②AlCl3因为能水解生成Al(OH)3和HCl,加热HCl挥发,水解彻底进行,生成Al(OH)3沉淀,灼烧Al(OH)3得Al2O3,故②正确;
③PH试纸湿润相当与稀释待测液,测量pH值不准确,故③错误;
④用pH相同的两种酸与锌反应,起始时,溶液中氢离子浓度相同,反应速率相同,不能判断酸性强弱,故④错误;
⑤锥形瓶用待测液润洗,待测液的物质的量增多,导致标准液的体积偏大,影响测定结果,故⑤错误;
故选A.
点评 本题考查了盐类水解的分析应用,主要是溶液PH测定方法,滴定实验的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
20.下列联系实际的说法正确的是( )
| A. | 可燃冰就是固态甲烷 | |
| B. | 人类目前直接利用的能量大部分是由化学反应产生的 | |
| C. | 煤、石油、天然气都是可再生能源 | |
| D. | 硫和碳的氧化物是形成酸雨的主要物质 |
1.如图所示的实验操作,能达到相应目的是( )
| A. | 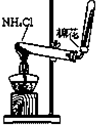 实验室制氯气 | B. |  检验K2CO3中的K+ | ||
| C. | 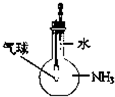 证明氨气吸易溶于水 | D. |  排水集气法收集NO |
5.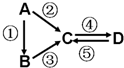 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )| A. | 若A是单质,C、D是氧化物,且D能与水反应生成强酸,则A一定是硫 | |
| B. | 若A是一种淡黄色固体,①②反应都有共同的单质生成,则A中阳阴离子个数比为1:1 | |
| C. | 若A物质具有两性,D为白色沉淀,则反应④的转化通入二氧化碳或氨气都能实现 | |
| D. | 若A是应用最广泛的金属,且A与C反应生成D,则②⑤反应的另一反应物一定是Cl2 |
15.把0.05mol NaOH固体分别加入到下列100mL液体中,溶液的导电能力变化不大的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 醋酸 | D. | 0.5 mol•L-1 氨水 |
19.在一个固定容积的密闭容器中,2molA和1molB发生反应2A(g)+B(g)?3C(g),达到平衡时,C的浓度为W mol/L.维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是( )
| A. | 4molA+2molB | B. | 1molA+0.5molB+1.5molC | ||
| C. | 3molC+1molB | D. | 3molC+2molA+1molB |
20.元素的种类主要取决于( )
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 最外层电子数 |



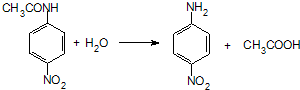 .
. 、F
、F .
. (其中两种).
(其中两种).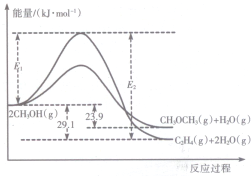 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应: