题目内容
13.丙烷高温分解生成甲烷和乙烯两种气体,现将丙烷分解后气体1L,充分燃烧后生成CO22.25L,则丙烷的分解率为( )| A. | 20% | B. | 33.3% | C. | 50% | D. | 75% |
分析 设丙烷体积为YL,其中有X L的丙烷分解,依据丙烷分解方程式,列出三段式,依据碳原子个数守恒及燃烧得到二氧化碳关系计算解答.
解答 解:设共有C3H8 Y L,其中有X L的C3H8分解,
C3H8→CH4 +C2H4
起始时 Y 0 0
转化量 X X X
终止时 Y-X X X
分解后气体共1L,即Y-X+X+X=1,X+Y=1,故Y=1-X
分解后气体1L中 有 Y-X=1-2X L的C3H8 X L的CH4 XL的C2H4
依据碳原子守恒可知:1-2X L的C3H8生成的CO2有 3(1-2X),
CH4生成的CO2有 XL,
C2H4生成的CO2有 2X L
所以:3-6X+2X+X=2.25
解得X=0.25,所以原来丙烷有1-2X+X=0.75L,分解的丙烷就是0.25升,
丙烷的分解率就是$\frac{0.25}{0.75}$×100%=33.3%;
故选:B.
点评 本题考查了有关方程式的计算,明确丙烷分解的方程式结合碳原子个数守恒即可解答,题目难度不大.

练习册系列答案
相关题目
3.分布在三个不同短周期的四种元素A、B、C、D的原子序数依次增大,其中B、C同周期,A、D同主族.常温下,BA3溶液的显碱性;C是地壳中含量最高的元素;D是所在周期原子半径最大的元素.下列说法正确的是( )
| A. | 原子半径:D>C>B>A | |
| B. | 气态氢化物的热稳定性:HmB>HnC | |
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 | |
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22.4升(标准状况) |
4.银锌纽扣电池的总反应式为Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
| A. | 锌做负极 | B. | 放电时,正极产物是银 | ||
| C. | 电解质溶液不可能呈酸性 | D. | 充电时发生了原电池反应 |
1.如图所示的实验操作,能达到相应目的是( )
| A. | 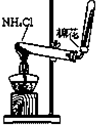 实验室制氯气 | B. |  检验K2CO3中的K+ | ||
| C. | 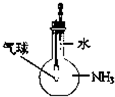 证明氨气吸易溶于水 | D. |  排水集气法收集NO |
8.(1)向一定体积的密闭容器中加入2molA、0.6molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图I所示,其中t0~t1阶段c(B)画出.图Ⅱ为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.
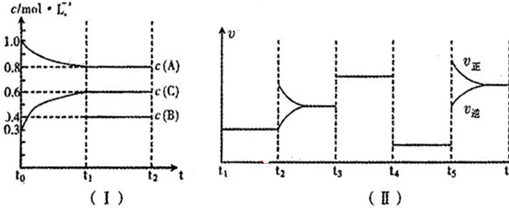
请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”、“<”或“=”连接);
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g) 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol
(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.

请回答下列问题:
①若t1=30min,则t0~t1阶段以C物质的浓度变化表示的反应速率为0.01 mol/(L•min);
②t4~t5阶段改变的条件为减小压强,B的起始物质的量浓度为0.5mol/L.各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
③t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为aKJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol(2)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是硫酸锰或Mn2+的催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是B
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰.
5.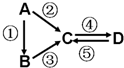 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )| A. | 若A是单质,C、D是氧化物,且D能与水反应生成强酸,则A一定是硫 | |
| B. | 若A是一种淡黄色固体,①②反应都有共同的单质生成,则A中阳阴离子个数比为1:1 | |
| C. | 若A物质具有两性,D为白色沉淀,则反应④的转化通入二氧化碳或氨气都能实现 | |
| D. | 若A是应用最广泛的金属,且A与C反应生成D,则②⑤反应的另一反应物一定是Cl2 |



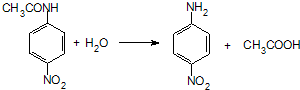 .
.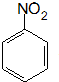 、F
、F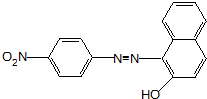 .
.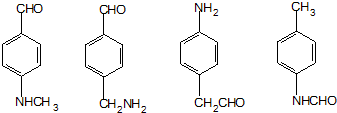 (其中两种).
(其中两种).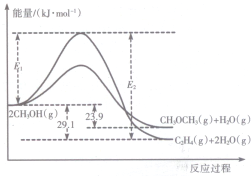 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为 .
. ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.