题目内容
14.下列结论正确的是( )| A. | Na、Cs 是同一主族的元素,所以 NaCl、CsCl晶体的空间结构相似 | |
| B. | HF、HCl、HBr、HI的相对分子质量依次增大,则沸点依次升高 | |
| C. | C、Si均为第ⅣA族元素,则CO2与SiO2的物理性质相似 | |
| D. | NH3分子的价层电子对对数为4,但空间构型为三角锥形 |
分析 A.Na、Cs 是同一主族的元素,所以 NaCl、CsCl晶体的空间结构不相似;
B.同一主族氢化物的相对分子质量越大其熔沸点越高,但含有氢键的氢化物熔沸点最高;
C.C、Si均为第ⅣA族元素,但CO2与SiO2的物理性质不同;
D.氨气分子中氮原子价层电子对个数是4且含有一个孤电子对,其空间构型是三角锥形.
解答 解:A.Na、Cs 是同一主族的元素,所以 NaCl、CsCl晶体的空间结构不相似,NaCl中阴阳离子配位数是6、CsCl中阴阳离子配位数是8,故A错误;
B.同一主族氢化物的相对分子质量越大其熔沸点越高,但含有氢键的氢化物熔沸点最高,HF中含有氢键,其熔沸点最高,故B错误;
C.C、Si均为第ⅣA族元素,但CO2是分子晶体、SiO2是原子晶体,所以其物理性质不同,故C错误;
D.氨气分子中氮原子价层电子对个数是4且含有一个孤电子对,其VSEPR模型是正四面体结构,但其空间构型是三角锥形,故D正确;
故选D.
点评 本题考查分子晶体熔沸点比较、分子空间构型判断、晶体结构等知识点,侧重考查学生分析判断能力,难点是分子空间构型的判断,注意氢键只影响物理性质不影响化学性质,题目难度不大.

练习册系列答案
相关题目
4.银锌纽扣电池的总反应式为Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
| A. | 锌做负极 | B. | 放电时,正极产物是银 | ||
| C. | 电解质溶液不可能呈酸性 | D. | 充电时发生了原电池反应 |
5.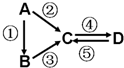 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
 无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )
无机物A、B、C、D均为中学化学常见的纯净物,且均含有一种相同元素,它们之间有如图的反应关系(部分生成物和反应条件略去).则下列推断正确的是( )| A. | 若A是单质,C、D是氧化物,且D能与水反应生成强酸,则A一定是硫 | |
| B. | 若A是一种淡黄色固体,①②反应都有共同的单质生成,则A中阳阴离子个数比为1:1 | |
| C. | 若A物质具有两性,D为白色沉淀,则反应④的转化通入二氧化碳或氨气都能实现 | |
| D. | 若A是应用最广泛的金属,且A与C反应生成D,则②⑤反应的另一反应物一定是Cl2 |
9.化学与生活、生产、环境等密切相关.下列说法错误的是( )
| A. | 煤的液化、石油的裂化和油脂的皂化都属于化学变化 | |
| B. | 糖、油脂和蛋白质都是人体生命活动所需的基本营养物质 | |
| C. | 静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量 | |
| D. | 硝酸纤维、聚酯纤维和光导纤维都可由纤维素在一定条件下制得 |
19.在一个固定容积的密闭容器中,2molA和1molB发生反应2A(g)+B(g)?3C(g),达到平衡时,C的浓度为W mol/L.维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为W mol/L,该配比是( )
| A. | 4molA+2molB | B. | 1molA+0.5molB+1.5molC | ||
| C. | 3molC+1molB | D. | 3molC+2molA+1molB |
6.乙烷与氯气在光照条件先发生取代反应所得有机产物数目共有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
4.下列各指定微粒的数目比不是1:1的是( )
| A. | Na2O2中阴离子和阳离子 | B. | NaOH晶体中阳离子和阴离子 | ||
| C. | ${\;}_{12}^{24}$Mg2+离子中的质子和中子 | D. | 氯化钠中的质子总数和电子总数 |
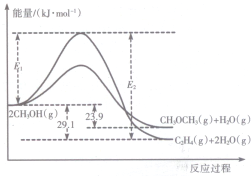 醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
醇是重要的有机化工原料.一定条件下,甲醇可同时发生下面两个反应:
 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为 .
. ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.