题目内容
【题目】下列离子方程式正确的有
A.向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:
Ca2++2ClO- +2H2O+2SO2= CaSO4↓+2Cl- +4H++SO42-
B.向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-![]() SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2O
C.向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+ OH-![]() H2O +CO32-
H2O +CO32-
D.用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
【答案】A
【解析】
试题分析:A、次氯酸钙的物质的量是0.001mol,二氧化硫是0.002mol,因此次氯酸根离子恰好把二氧化硫氧化为硫酸根,进而生成硫酸钙沉淀,离子方程式正确,A正确;B、浓硫酸用化学式表示。B错误;C、氢氧化钠过量,还有碳酸钠生成,C错误;D、固体之间的反应不是离子反应,D错误。答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】电解质溶液导电的本质是阴阳离子在电场作用下迁移,通过实验探究同一溶液中不同离子的迁移差异。将pH试纸用不同浓度Na2SO4的溶液充分浸湿,进行如下实验:
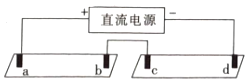
a,b,c,d均是石墨电极,电极间距4cm,电极电流0.20mA。实验现象:
时间 | 试纸Ⅰ | 试纸Ⅱ |
1min | a极试纸附近变红,b极附近试纸变蓝 | c极附近试纸变红,d极附近变蓝 |
10min | 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm | 两极颜色范围扩大不明显,试纸大部分仍为黄色 |
对实验现象解释及预测不合理的是( )
A.b、d两极附近变蓝的原因:2H2O+2e-=H2↑+2OH-
B.试纸Ⅰ红色区长度大于蓝色区:说明单位时间内OH-的迁移速度快于H+
C.试纸Ⅱ中的现象说明此浓度下迁移的主要离子是Na+和SO42-
D.预测10min后,试纸Ⅰ红蓝区之间又会出现黄色区域