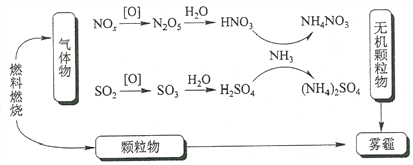
题目内容
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

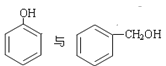
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
【答案】浓HCl MnO2 MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中混有的HCl A 有黄色沉淀生成 Cl2+S2-=S↓+2Cl- B
Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中混有的HCl A 有黄色沉淀生成 Cl2+S2-=S↓+2Cl- B
【解析】
(1)从实验室制取氯气的原理分析;
(2)制取氯气时,浓盐酸易挥发,则虚线框内的装置图中所加试剂为除HCl气态,则为饱和食盐水;
(3)氯气与硫化钠反应生成单质硫,氯气为氧化剂、硫为氧化产物,氯的氧化性大于硫;
(4)氯比硫非金属性强,则其气态氢化物的稳定性越强,反应越容易;其最高价氧化物对应水化物的酸性越强;与变价金属反应生成高价态的非金属性较强。
(1)根据实验目的可知,验证氯元素的非金属性比硫元素的非金属性强,则装置A为制取氯气的装置,其反应原理为浓盐酸与二氧化锰共热,则分液漏斗中盛有浓盐酸,其反应的离子方程式为:MnO2+ 4H+ +2Cl-(浓)![]() Mn2+ + Cl2↑+2H2O,故答案为:浓HCl;MnO2;MnO2+4H++2Cl-
Mn2+ + Cl2↑+2H2O,故答案为:浓HCl;MnO2;MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)制取氯气时,浓盐酸易挥发,则虚线框内的装置图中所加试剂为除HCl气态,则为饱和食盐水,故答案为:饱和食盐水;除去Cl2中的HCl气体;
(3)氯气与硫化钠反应生成单质硫,氯气为氧化剂、硫为氧化产物,氯的氧化性大于硫,方程式为:Na2S+Cl2=2NaCl+S↓,离子方程式为:Cl2+S2-=S↓+2Cl-,现象为:有黄色沉淀生成,故答案为:A;有黄色沉淀生成;Cl2+S2-=S↓+2Cl-;
(4)氯比硫非金属性强,则其气态氢化物的稳定性越强,反应越容易,则④正确;其最高价氧化物对应水化物的酸性越强,则①错误、②正确;与变价金属反应生成高价态的非金属性较强,则⑥正确;对应离子的还原性越弱,则③正确;综上正确为:②③④⑥,答案为:B。

【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
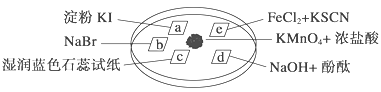
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D