题目内容
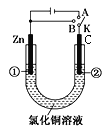
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
【答案】C
【解析】
A、根据反应的化学方程式可知N元素的化合价升高,被氧化,所以通入氨气的一极为负极,右端为正极,所以电流从右侧电极经过负载后流向左侧电极,A正确;
B、A为负极,发生氧化反应,B是正极,发生还原反应,B正确;
C、电极A是氨气失去电子生成氮气,由于电解质溶液为KOH溶液,所以氨气失去电子与氢氧根离子结合生成水,电极反应式为2NH3-6e-+6OH-=N2+6H2O,C错误;
D、标准状况下2.24L二氧化氮的物质的量是0.1mol,N元素的化合价从+4价降低到0价,则0.1mol二氧化氮参加反应时转移电子的物质的量是0.4mol,D正确。
答案选C。

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目