题目内容
同浓度同体积的醋酸与盐酸相比,下列既能表明醋酸是弱酸,又能表明盐酸是强酸的是( )
| A、c(H+):盐酸大于醋酸 |
| B、盐酸中:c(H+)=c(Cl-),醋酸中:c(H+)<c(CH3COOH) |
| C、c(Cl-)>c(CH3COO-) |
| D、盐酸中:无氯化氢分子;醋酸中:存在大量醋酸分子 |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:A.只能说明盐酸酸性比醋酸强,醋酸是弱酸,不能说明盐酸是强酸;
B.盐酸是强酸,不存在电离平衡,醋酸是弱酸,存在电离平衡;
C.只能说明盐酸酸性比醋酸强,醋酸是弱酸,不能说明盐酸是强酸;
D.盐酸是强酸,不存在电离平衡,醋酸是弱酸,存在电离平衡;
B.盐酸是强酸,不存在电离平衡,醋酸是弱酸,存在电离平衡;
C.只能说明盐酸酸性比醋酸强,醋酸是弱酸,不能说明盐酸是强酸;
D.盐酸是强酸,不存在电离平衡,醋酸是弱酸,存在电离平衡;
解答:
解:A.c(H+):盐酸大于醋酸,只能说明盐酸酸性比醋酸强,醋酸是弱酸,但不能说明盐酸是强酸,故A错误;
B.盐酸中:c(H+)=c(Cl-),不能确定盐酸完全电离,醋酸中:c(H+)<c(CH3COOH),说明醋酸是弱酸,存在电离平衡,故B错误;
C.c(Cl-)>c(CH3COO-),只能说明盐酸酸性比醋酸强,醋酸是弱酸,不能说明盐酸是强酸,故C错误;
D.盐酸中:无氯化氢分子;醋酸中:存在大量醋酸分子,说明盐酸是强酸,不存在电离平衡,醋酸是弱酸,存在电离平衡,故D正确;
故选D.
B.盐酸中:c(H+)=c(Cl-),不能确定盐酸完全电离,醋酸中:c(H+)<c(CH3COOH),说明醋酸是弱酸,存在电离平衡,故B错误;
C.c(Cl-)>c(CH3COO-),只能说明盐酸酸性比醋酸强,醋酸是弱酸,不能说明盐酸是强酸,故C错误;
D.盐酸中:无氯化氢分子;醋酸中:存在大量醋酸分子,说明盐酸是强酸,不存在电离平衡,醋酸是弱酸,存在电离平衡,故D正确;
故选D.
点评:本题考查强弱电解质的电离,题目难度中等,本题注意把握弱电解质的电离特点,部分电离,存在电离平衡.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
A、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| B、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| C、将少量醋酸溶液滴加到Na2CO3溶液中的反应:CH3COOH+CO32-=CH3COO-+HCO3- | ||||
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z,下列叙述正确的是( )
| A、X、Y、Z的稳定性逐渐增强 |
| B、X、Y、Z三种化合物的熔沸点逐渐升高 |
| C、A、B、C、D只能形成四种单质 |
| D、只含有A、B、C、D 四种元素的化合物有两种 |
春运期间,一些易燃、易爆、剧毒品、腐蚀品等,严禁带上客车.在下列化学药品中允许带上客车的是
( )
( )
| A、浓硫酸 | B、氰化钾 |
| C、汽油 | D、漂白粉 |
下列说法正确的是( )
| A、相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3?H2O |
| B、为了确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、0.2mol?L-1的CH3COONa溶液与0.1mol?L-1的HCl等体积混合呈酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| D、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
下列与实验相关的叙述正确的是( )
| A、用苯萃取溴水中的Br2时,有机层从分液漏斗的下端放出 |
| B、检验溶液中是否含有SO42-,依次滴入Ba(NO3)2溶液和稀盐酸 |
| C、配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| D、配制AlCl3溶液时,将AlCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 |
下列说法正确的是( )
| A、金属钠着火可用煤油扑灭 |
| B、将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 |
| C、向含有等量NaI、NaCl的溶液中滴加AgNO3溶液,先产生白色沉淀 |
| D、用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
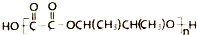 的合成路线流程图(无机试剂任用).合成路线流程图如图:
的合成路线流程图(无机试剂任用).合成路线流程图如图: