题目内容
13.某有机物的结构简式为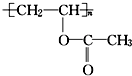 ,下列关于该有机物叙述不正确的是( )
,下列关于该有机物叙述不正确的是( )| A. | 1 mol 该有机物与 NaOH 溶液完全反应时,消耗 NaOH 1 mol | |
| B. | 该有机物水解所得产物能发生取代反应 | |
| C. | 该有机物可通过加聚反应生成 | |
| D. | 该有机物分子中含有双键 |
分析 由结构简式可知,分子中含n个-COOC-,单体为CH2=CHOOCCH3,结合酯的性质来解答.
解答 解:A.分子中含n个-COOC-,1mol该有机物与NaOH溶液完全反应时,消耗NaOH nmol,故A错误;
B.水解反应生成聚乙烯醇和乙酸,为取代反应,故B正确;
C.高分子主链只有2个C,为加聚反应产物,该有机物可通过加聚反应生成,故C正确;
D.含有酯基,含有C=O双键,故D正确;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯、烯烃性质的考查,注意聚合度的分析,题目难度不大.

练习册系列答案
相关题目
16.下列关于化学反应的限度的叙述中,正确的是( )
| A. | 任何化学反应的限度都相同 | |
| B. | 可以通过改变温度控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 |
17.某元素的一种核素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是( )
| A. | $\frac{a}{A+m}$(A-N+m)mol | B. | $\frac{a}{Am}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N)mol | D. | $\frac{a}{A}$(A-N+m)mol |
8.化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )
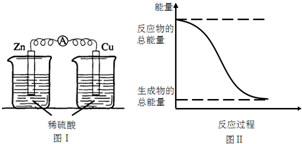

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 图II所示的反应为吸热反应 |
18.下列原因解释与氢键无关的( )
| A. | CH4的沸点比SiH4低,而CH4比SiH4热稳定性强 | |
| B. | 有机物大多难溶于水,而乙醇和乙酸可与水互溶 | |
| C. | H2O2和H2S的相对分子相近,而H2O2的沸点远高于H2S | |
| D. | 采用加压液化的方法从氨合成塔里分离出NH3 |
5.下列说法中正确的是( )
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 在周期表里,主族元素所在的族序数等于原子核外电子数 |
2.100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 水 | C. | 硫酸钾溶液 | D. | 浓硝酸 |
3.如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )
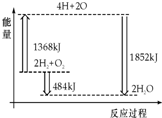

| A. | H2(g)和O2(g)反应生成H2O(g ),这是吸热反应 | |
| B. | 2 mol H2和1 mol O2转化为4 mol H、2 mol O原子的过程中放出热量 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O( g),共放出484 kJ能量 | |
| D. | 4 mol H、2 mol O生成2 mol H2O(g),共放出484 kJ能量 |