题目内容
【题目】运用元素周期表分析下列判断,其中错误的是( )
A.铍(Be)的氧化物的水合物可能是两性氧化物
B.硒化氢(![]() )是有色、有毒的气体,比
)是有色、有毒的气体,比![]() 稳定
稳定
C.![]() 的酸性比
的酸性比![]() 的酸性弱
的酸性弱
D.砹(At)为有色固体,HAt不稳定,AgAt感光性强,不溶于一般的酸
【答案】B
【解析】
A. 元素周期表中Be和Al处于对角线位置上,处于对角线的元素具有相似性,BeO、Be(OH)2均有两性,故A正确,不符合题意;
B. 同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以硒化氢(H2Se)不如H2S稳定,故B错误,符合题意;
C.硫元素与硒元素是同一主族元素,从上到下非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,故C正确,不符合题意;
D. 卤族元素性质具有相似性,根据碘单质的性质可推断At为有色物质,AgI不溶于水也不溶于稀酸,AgAt难溶于水也不溶于稀硝酸,但同主族元素的原子,从上到下氢化物的稳定性逐渐减弱,所以HAt不如HI稳定,故D正确,不符合题意;
故选:B。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
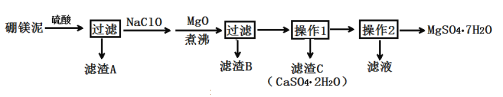
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。