题目内容
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
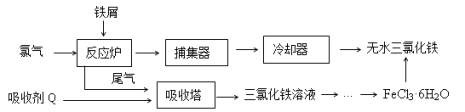
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
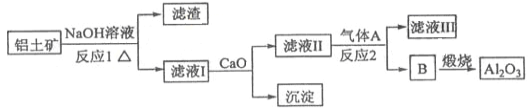
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1)写出反应1的化学方程式__________________________;
(2)滤液Ⅰ中加入CaO生成的沉淀是____________,反应2的离子方程式为____________________;
(3)E可作为建筑材料,化合物C是__________,写出由D制备冰晶石的化学方程式____________;
(4)电解制铝的化学方程式是__________________,以石墨为电极,阳极产生的混合气体的成分是__________________。
【答案】(1)2NaOH+SiO2=Na2SiO3+H2O(2分),2NaOH+Al2O3=2NaAlO2+H2O(2分)
(2)硅酸钙沉淀(2分)2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
(3)浓H2SO4;(2分)12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O(2分)
(4)2Al2O3(熔融)![]() 4Al+3O2↑(2分) O2、CO2(或CO)
4Al+3O2↑(2分) O2、CO2(或CO)
【解析】
试题分析:(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为2NaOH+Al2O3=2NaAlO2+H2O。
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;由工艺流程可知,B为氢氧化铝,气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-。
(3)由工艺流程可知,气体D含有F元素,应是HF,C为浓硫酸;根据元素守恒可知,HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+ 3CO2+9H2O;
(4)电解熔融的氧化铝生成铝与氧气,反应方程式为2Al2O3(熔融)![]() 4Al+3O2↑,阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO,阳极气体有O2、CO2(或CO)。
4Al+3O2↑,阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO,阳极气体有O2、CO2(或CO)。

 综合自测系列答案
综合自测系列答案