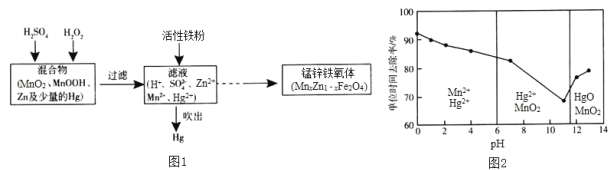
题目内容
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯代物的数目分别是( )[
A.2个甲基,可能生成4种一氯代物
B.3个甲基,可能生成3种一氯代物
C.3个甲基,可能生成5种一氯代物
D.4个甲基,可能生成4种一氯代物
【答案】C
【解析】
试题分析:A.含2个甲基,为CH3CH2CH2CH2CH2CH3,有3种H原子,则有3种一氯代物,故A错误;B.含3个甲基,有![]() 和
和![]() 两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故B错误;C.含3个甲基,有
两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故B错误;C.含3个甲基,有![]() 和
和![]() 两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故C正确;D.含4个甲基,则有
两种结构,前一种结构有5种一氯代物,后一种结构,有4种一氯代物,故C正确;D.含4个甲基,则有![]() 和
和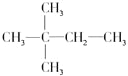 两种结构,前一种有2种一氯代物,后一种有3种一氯代物,故D错误;故选C。
两种结构,前一种有2种一氯代物,后一种有3种一氯代物,故D错误;故选C。

练习册系列答案
相关题目