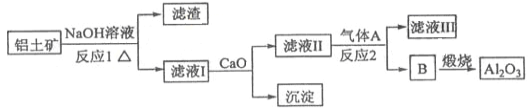
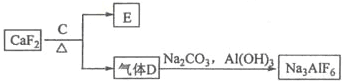
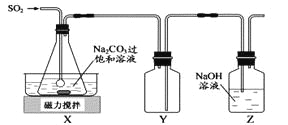
题目内容
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
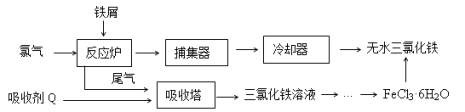
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)。
【答案】
(1)在通HCl气体的氛围下加热。
(2)蒸发浓缩;冷却结晶;
(3)2.6×10-9mol·L-1;
(4)①2Fe3++2I-=2Fe2++I2;
②氯化铁的质量分数88.32%。
【解析】
试题分析:(1)FeCl3水解生成的氯化氢易挥发,制备无水FeCl3应在通HCl气体的氛围下加热,故答案为:在通HCl气体的氛围下加热;
(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加热蒸发、冷却晶体.Fe3+易水解应先加入少量的盐酸,抑制Fe3+水解,再热蒸发、冷却晶体获得FeCl36H2O,故答案为:加热浓缩;再冷却结晶;
(3)当溶液pH为4时,溶液中c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.6×10-39,所以溶液中c(Fe3+)=![]() =2.6×10-9 molL-1,故答案为:2.6×10-9 molL-1;
=2.6×10-9 molL-1,故答案为:2.6×10-9 molL-1;
(4)10ml水样中存在的反应有:2Fe3++2I-=2Fe2++I2,I2+2S2O32-=2I-+S4O62-,n(FeCl3)=2n(I2)= n(Na2S2O3) =12.50mL ×10-3L·mL-1 ×0.1000 mol·L-1=1.25×10-3mol,氯化铁的质量分数= 162.5g.mol-1 ×1.25×10-3mol ×10l/2.300g ×100%=88.32%,故答案为:88.32%。

 阅读快车系列答案
阅读快车系列答案