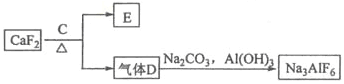
题目内容
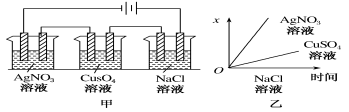
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是
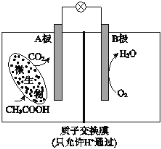
A.外电路电子从B极移向A极[来
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小[
D.A极电极反应式为:CH3COOH - 8e-+ 2H2O = 2CO2 + 8H+
【答案】D
【解析】
试题分析:根据图知,A电极上C元素化合价由0价变为+4价,则A是负极、B是正极,负极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,电解质溶液呈酸性,则正极反应式为O2+4e-+4H+=2H2O。A.通过以上分析知,A是负极、B是正极,电子从A流向B,故A错误;B.电池内电解质溶液中所含的H+由负极A移向正极B,故B错误;C.B极为正极,正极反应式为O2+4e-+4H+=2H2O,正极上消耗氢离子,所以溶液pH增大,故C错误;D.A电极上失电子发生氧化反应,则A极的电极反应为:CH3COOH-8e-+2H2O═2CO2↑+8H+,故D正确;故选D。

练习册系列答案
相关题目