题目内容
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
| A.该反应的氧化剂只有CuSO4 |
| B.SO42-既不是氧化产物也不是还原产物 |
C.1 mol CuSO4还原了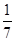 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为7:3 |
D
解析试题分析:A、根据方程式可知硫酸铜中铜元素的化合价从+2价降低到+1价,得到1个电子,硫酸铜是氧化剂。FeS2中S元素的化合价从-1价部分升高到+6价,失去7个电子,做还原剂。部分从-1价降低到-2价,做氧化剂,A不正确;B、部分SO42-是氧化产物,B不正确;C、硫酸铜是氧化剂,因此1 mol CuSO4氧化了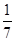 mol的S,C不正确;D、根据方程式和电子得失守恒可知,14mol硫酸铜氧化1mol FeS2。另外4mol FeS2中有3.5mol是氧化剂,0.5mol是还原剂,所以被还原的S和被氧化的S的质量比=3.5×2:(0.5×2+1×2)=7:3,D正确,答案选D。
mol的S,C不正确;D、根据方程式和电子得失守恒可知,14mol硫酸铜氧化1mol FeS2。另外4mol FeS2中有3.5mol是氧化剂,0.5mol是还原剂,所以被还原的S和被氧化的S的质量比=3.5×2:(0.5×2+1×2)=7:3,D正确,答案选D。
考点:考查氧化还原反应的有关判断和计算

练习册系列答案
相关题目
关于反应Zn+ 2HNO3+ NH4NO3→ N2↑+ 3H2O+ Zn(NO3)2,下列判断正确的是
| A.生成1 mol N2,电子转移总数为3NA | B.生成1 mol N2,电子转移总数为5NA |
| C.溶解1 mol Zn,电子转移总数为2NA | D.溶解1 mol Zn,电子转移总数为4NA |
水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O
下列说法中不正确的是
| A.每生成1mol Fe(FeO2)2转移4mol电子 | B.该反应中Fe2+和S2O32-都是还原剂 |
| C.3mol Fe2+被氧化时有1molO2被还原 | D.反应方程式中化学计量数x=4 |
在反应3Cl2+8 NH3 = N2+6NH4Cl中,氧化剂与还原剂的物质的量之比为( )
| A.8:3 | B.3:8 | C.3:2 | D.1:3 |
关于反应3Cl2 + 6KOH 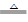 KClO3 + 5KCl + 3H2O,以下说法正确的是
KClO3 + 5KCl + 3H2O,以下说法正确的是
| A.KOH既不是氧化剂,又不是还原剂 |
| B.Cl2是氧化剂,KOH是还原剂 |
| C.3mol氯气参加反应转移6 mol电子 |
| D.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |
下列变化,加入氧化剂才能实现的是
| A.Na2S→H2S | B.CO2→CO | C.FeO→Fe2O3 | D.AlCl3→Al(OH)3 |
将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3= 9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.稀HNO3在反应中只表现氧化性 |
| C.磁性氧化铁中的所有铁元素全部被氧化 |
| D.反应中每还原0.3mol氧化剂,就有0.9mol电子转移 |
将0.195g锌粉加入到20mL 0.100 mol?L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |