题目内容
将0.195g锌粉加入到20mL 0.100 mol?L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
B
解析试题分析:n(Zn)=0.195g/(65g/mol)=0.003mol,n(MO2+)=0.02L×0.100mol?L-1=0.002mol,设反应后M的化合价为+x价,则(5-x)×0.002mol=0.003mol×(2-0),x=2,故选B。
考点:氧化还原反应的计算

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
| A.该反应的氧化剂只有CuSO4 |
| B.SO42-既不是氧化产物也不是还原产物 |
C.1 mol CuSO4还原了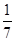 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为7:3 |
天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4=3N2 + 4H2O + 2CO2,下列叙述错误的是
| A.此反应可在瞬间产生大量高温气体,推动火箭飞行 |
| B.此反应是氧化还原反应,N2O4做还原剂 |
| C.此反应是氧化还原反应,偏二甲肼做还原剂 |
| D.此反应中R的分子式为C2H8N2 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是( )
| A.2Na + 2H2O=2NaOH + H2↑ |
| B.2F2+2H2O=4HF+O2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为( )
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
下列有关说法错误的是( )
| A.H2O2、Na2O2都属于过氧化物、都存在非极性共价键 |
| B.H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 |
| C.双氧水是绿色氧化剂,可作医疗消毒剂 |
| D.H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
已知NH4CuSO3与足量的10 mol/L硫酸混合微热,产生下列现象:①有红色金属生成;②产生刺激性气味的气体;③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1 mol NH4CuSO3完全反应转移0.5 mol电子 |
下列反应进行分类时,既属于氧化还原反应又属于置换反应的是
| A.Zn+H2SO4=ZnSO4+H2↑ | B.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
C.S+O2 SO2 SO2 | D.CH4+2O2 CO2+2H2O CO2+2H2O |
