题目内容
在反应3Cl2+8 NH3 = N2+6NH4Cl中,氧化剂与还原剂的物质的量之比为( )
| A.8:3 | B.3:8 | C.3:2 | D.1:3 |
C
解析试题分析:在反应3Cl2+8 NH3 = N2+6NH4Cl中:氯元素由反应前Cl2的0价变为反应后NH4Cl的-1价,化合价降低,得到电子,作氧化剂;氮元素由反应前NH3中的-3价变为反应后N2中的0价,化合价升高,失去电子作还原剂。在参加反应的8个NH3中有2个被氧化,起还原剂的作用。故氧化剂与还原剂的物质的量之比为3:2。选项为C。
考点:考查氧化还原反应中氧化剂与还原剂的物质的量关系的计算的知识。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
对于反应3Br2+6NaOH=5NaBr+NaBrO3+3H2O,以下叙述正确的是
| A.Br2是氧化剂,NaOH是还原剂 |
| B.氧化产物与还原产物的物质的量的比为5∶1 |
| C.Br2既是氧化剂又是还原剂 |
| D.每生成1mol的NaBrO3转移6mol的电子 |
根据表中信息判断,下列选项不正确的是( )
| 序列 | 参加反应的物质 | 生成物 |
| ① | KMnO4 、H2O2 、H2SO4 | K2SO4 、MnSO4…… |
| ② | Cl2 、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- …… | Cl2 、Mn2+ …… |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4- > Cl2 > Fe3+ > Br2
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
Li2NH+H2 LiNH2+LiH,下列有关说法正确的是( )
LiNH2+LiH,下列有关说法正确的是( )
| A.Li2NH中N的化合价是-1 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H-的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
下列变化中,需加入适当的氧化剂才能完成的是
| A.Fe → FeCl3 | B.CuO → Cu | C.HNO3 → NO | D.SO3 → H2SO4 |
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
| A.该反应的氧化剂只有CuSO4 |
| B.SO42-既不是氧化产物也不是还原产物 |
C.1 mol CuSO4还原了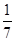 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为7:3 |
下列反应不属于四种基本反应类型,但属于氧化还原反应的是
| A.Fe+CuSO4=FeSO4+Cu |
B.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
| C.AgNO3+NaCl=AgCl↓+NaNO3 |
D.2KMnO4 K2MnO4 +MnO2 +O2↑ K2MnO4 +MnO2 +O2↑ |
下列反应中,水只表现氧化性的是
| A.2Na +2H2O =2NaOH +H2↑ |
| B.Cl2 +H2O =HCl + HClO |
| C.2F2 +2H2O =4HF +O2 |
| D.CaO +H2O =Ca(OH)2 |