题目内容
将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3= 9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
| A.Fe(NO3)x中的x为2 |
| B.稀HNO3在反应中只表现氧化性 |
| C.磁性氧化铁中的所有铁元素全部被氧化 |
| D.反应中每还原0.3mol氧化剂,就有0.9mol电子转移 |
D
解析试题分析:A、根据氮原子守恒,得出x为3,错误;B、稀硝酸表现为氧化性和酸性,错误;C、磁性氧化铁中铁的价态为+2+3的混合价态,只有+2价铁才被氧化,错误;D、0.3mol×3=0.9mol,正确。
考点:考查氧化还原反应有关问题。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO固体120g,若上述气体为NO,则a可能为 mol.
| A.2.50 | B.4.00 | C.7.50 | D.3.15 |
对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4的下列说法正确的是
| A.该反应的氧化剂只有CuSO4 |
| B.SO42-既不是氧化产物也不是还原产物 |
C.1 mol CuSO4还原了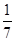 mol的S mol的S |
| D.被还原的S和被氧化的S的质量比为7:3 |
金属钾的冶炼可采用如下方法:2KF+CaC2 CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
| A.该反应的氧化剂是KF,氧化产物是K |
| B.该反应能说明C的还原性大于K |
| C.电解KF溶液不可能制备金属钾 |
| D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1 |
下列反应中,水只表现氧化性的是
| A.2Na +2H2O =2NaOH +H2↑ |
| B.Cl2 +H2O =HCl + HClO |
| C.2F2 +2H2O =4HF +O2 |
| D.CaO +H2O =Ca(OH)2 |
①14Cu2++5FeS2+12H2O = 7Cu2S + 5Fe2+ + 24H++3SO42-
②Mn2+ + S2O82- + H2O— MnO4- + SO42- H+
对上述两个反应判断正确的是:
| A.①②反应中SO42—都是氧化产物 |
| B.两个反应中电子转移数目都是10mol |
| C.①反应中的硫元素既被氧化又被还原 |
| D.氧化性:MnO4—> S2O82— |
天宫一号搭载的长征二号火箭使用的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R + 2N2O4=3N2 + 4H2O + 2CO2,下列叙述错误的是
| A.此反应可在瞬间产生大量高温气体,推动火箭飞行 |
| B.此反应是氧化还原反应,N2O4做还原剂 |
| C.此反应是氧化还原反应,偏二甲肼做还原剂 |
| D.此反应中R的分子式为C2H8N2 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用相同的是( )
| A.2Na + 2H2O=2NaOH + H2↑ |
| B.2F2+2H2O=4HF+O2 |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
下列反应进行分类时,既属于氧化还原反应又属于置换反应的是
| A.Zn+H2SO4=ZnSO4+H2↑ | B.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
C.S+O2 SO2 SO2 | D.CH4+2O2 CO2+2H2O CO2+2H2O |