题目内容
2.关于H2O的说法正确的是( )| A. | H2O的相对分子质量是18克 | |
| B. | H2O的摩尔质量是18克 | |
| C. | 标准状况下H2O的摩尔体积是22.4L.mol-1 | |
| D. | 1mol H2O的质量是18克 |
分析 摩尔质量的单位为g/mol,结合m=nM解答该题,注意标准状况下,水为液体.
解答 解:A.H2O的相对分子质量是18,故A错误;
B.H2O的摩尔质量是18g/mol,故B错误;
C.标准状况下,水为液体,故C错误;
D.H2O的摩尔质量是18g/mol,则1mol H2O的质量是18克,故D正确.
故选D.
点评 本题综合考查物质的量的计算,侧重概念的考查,注意把握相关基础知识的学习,难度不大.

练习册系列答案
相关题目
13.下列离子方程式书写正确的是( )
| A. | 三氯化铁溶液中加入铁粉:Fe3++Fe═2Fe2+ | |
| B. | 苯酚钠溶液中通入少量CO2:CO2+H2O+C6H5O-→C6H5OH+HCO3- | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++4Cl-═Mn2++Cl2↑+2H2O |
10.下列离子方程式书写正确的是( )
| A. | MgSO4 溶液与Ba(OH)2溶液反应:SO42-+Ba2+═Ba SO4↓ | |
| B. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 铝片与氢氧化钠溶液反应:2Al+2OH--+2H2O═AlO2-+3H2↑ | |
| D. | 氢氧化铁溶于氢碘酸中Fe(OH)3+3H+═Fe3++3H2O |
17.下列实验设计方案中,可行的是( )
| A. | 先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 | |
| B. | 用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
7.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )
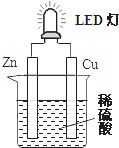

| A. | 铜片表面有气泡生成,且铜片为正极,为电子流入的一极 | |
| B. | 如果将硫酸换成苹果汁,导线中不会有电子流动 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将锌片换成铁片,电路中的电流方向由铜片经导线流向铁片,铁片发生氧化反应 |

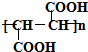 ;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1;
;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1; ,反应类型:消去反应;
,反应类型:消去反应;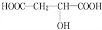 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$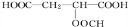 +H2O,反应类型:取代反应;
+H2O,反应类型:取代反应;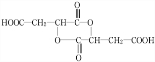 ;
;