题目内容
18.下列关于化学键说法中不正确的是( )| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子间相互结合,也可以使原子间相互结合 | |
| C. | 化学反应过程中反应物化学键断裂,生成物化学键形成 | |
| D. | 氯化钠固体溶于水没有新物质生产,故没有破坏化学键 |
分析 A.化学键是相邻原子之间的作用力;
B.形成化学键的微粒可能是原子也可能是离子;
C.根据化学反应的实质判断;
D.氯化钠溶于水发生电离.
解答 解:A.化学键是相邻原子之间的强烈的相互作用,故A正确;
B.形成化学键的微粒可能是离子也可能是原子但不能是分子,故B正确;
C.化学反应的实质是有旧化学键的断裂和新化学键的形成,故C正确;
D.氯化钠溶于水发生电离,离子键被破坏,故D错误;
故选D.
点评 本题考查了化学键,明确化学键的含义是解本题关键,注意化学键中必须是“相邻原子之间的相互作用”,既包含吸引力也包含排斥力,配位键也属于化学键,但氢键不属于化学键,为易错点.

练习册系列答案
相关题目
14.下列各组物质,具有相同的最简式,但既不属于同分异构体又不属于同系物的是( )
①聚乙烯和乙烯
②甲醛和葡萄糖
③淀粉和纤维素
④蔗糖和麦芽糖
⑤聚乙烯和聚氯乙烯.
①聚乙烯和乙烯
②甲醛和葡萄糖
③淀粉和纤维素
④蔗糖和麦芽糖
⑤聚乙烯和聚氯乙烯.
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①②③ |
9.工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
(1)在标准状况下,将a L由SO2和Cl2组成的混合气体通入200mL 0.1mol/L的Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅.向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g.则混合气体中SO2的体积为0.896L,a的取值范围为:1.344<a<1.792.
(2)某温度下,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.开始时在100L的密闭容器中加入4.0
mol SO2(g)和10.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=3.33.
(3)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:
2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是ACF(填字母).
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
(4)常温时,BaSO4的Ksp=1.08×10-10.现将等体积的BaCl2溶液与2.0×10-3mol/L的Na2SO4溶液混合.若要生成BaSO4沉淀,BaCl2溶液的最小浓度为2.16×10-7mol/L.
(5)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.①一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.
如表为反应在T1温度下的部分实验数据:
则50s内NO2的平均生成速率为0.06mol•L-1•s-1.
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.
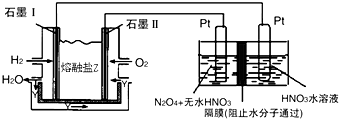
写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
(1)在标准状况下,将a L由SO2和Cl2组成的混合气体通入200mL 0.1mol/L的Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅.向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g.则混合气体中SO2的体积为0.896L,a的取值范围为:1.344<a<1.792.
(2)某温度下,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.开始时在100L的密闭容器中加入4.0
mol SO2(g)和10.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=3.33.
(3)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:
2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是ACF(填字母).
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
(4)常温时,BaSO4的Ksp=1.08×10-10.现将等体积的BaCl2溶液与2.0×10-3mol/L的Na2SO4溶液混合.若要生成BaSO4沉淀,BaCl2溶液的最小浓度为2.16×10-7mol/L.
(5)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.①一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g)△H>0.
如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol•L-1 | 5.0 | 3.5 | 2.4 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨I电极上发生反应的电极反应式H2+CO32--2e-=CO2+H2O.
7.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子总数为6NA | |
| D. | 17gOH-中含有的质子数为10NA |
8.已知在溶液中,KCl、K2SO4、ZnSO4、ZnCl2完全以离子形式存在.体积相同的两份植物营养液,其配方如下:
两份营养液中各离子的浓度( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | / |
| (2) | 0.1mol | 0.3mol | / | 0.1mol |
| A. | 完全相同 | B. | 完全不同 | C. | 仅c(K+)相同 | D. | 仅c(Cl-)相同 |
 二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂.
二氧化氯(C1O2)气体是一种常用高效的自来水消毒剂. ;检验元素X、Y、Z以质量比为1:7:12形成的化合物中所含阳离子的离子反应方程式是:
;检验元素X、Y、Z以质量比为1:7:12形成的化合物中所含阳离子的离子反应方程式是: