题目内容
7. Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.(1)E元素在周期表中的位置为第三周期第ⅢA族.
(2)由A、B、W三种元素组成的18电子微粒的电子式为
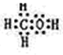 .
.(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式Cu+2H++H2O2=Cu2++2H2O.
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是56L(标准状况下).
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为3 Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+.
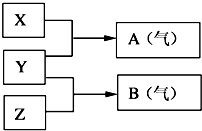
Ⅱ:X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:
(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,则:Y的化学式是H2;生成固体的电子式为
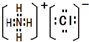 .
.(7)若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,则:将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为SO2+Cl2+2H2O═H2SO4+2HCl.
分析 I.A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素;
Ⅱ.(6)A和B为化合物,二者化合生成一种固体时的现象是有白烟,则二者是HCl和NH3,所以Y是H2,X、Z为氮气和氯气中的一种,AB化合生成的盐是氯化铵,为离子化合物;
(7)A 在空气中充分燃烧可生成B,B具有漂白性,则B是二氧化硫,A是硫化氢,所以Y是S,X、Z是分别是氢气和氧气,二氧化硫与氯水反应生成硫酸和氯化氢.
解答 解:I.A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素.
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,
故答案为:第三周期第ⅢA族;
(2)由H、C、O三种元素组成的18电子微粒,该微粒中只能含有1个C原子、1个O原子,故含有H原子数目=18-6-8=4,故该微粒结构简式为CH3OH,电子式为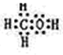 ,
,
故答案为: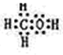 ;
;
(3)A2W2是H2O2,与稀硫酸、Cu发生氧化还原反应直接生成硫酸铜和水,无污染,离子方程式为:Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(4)Na与氢气化合生成NaH,与水反应生成NaOH和氢气,化学方程式为NaH+H2O=NaOH+H2↑,Al与氢氧化钠反应液可生成氢气,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,1molNaH与水反应生成1molNaOH和1mol氢气,1molAl与1molNaOH反应生成1.5mol氢气,所以共生成2.5mol的氢气,标准状况下的体积是2.5mol×22.4L/mol=56L;
故答案为:56L;
(5)过氧化钠为淡黄色固体,与水反应生成氢氧化钠和氧气,再与氯化亚铁发生氧化还原反应,最终生成的氧气全部氧化亚铁离子,1mol过氧化钠与水反应生成1molNaOH和0.5mol氧气,0.5mol氧气恰好氧化2molFe2+为Fe3+,所以2mol Fe3+与1molNaOH反应生成1mol Fe(OH)3沉淀,则反应的离子方程式为:3 Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
故答案为:3 Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
Ⅱ.(6)A和B为化合物,二者化合生成一种固体时的现象是有白烟,则二者是HCl和NH3,所以Y是H2,X、Z为氮气和氯气中的一种,AB化合生成的盐是氯化铵,为离子化合物,电子式为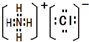 ,
,
故答案为:H2;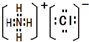 ;
;
(7)A 在空气中充分燃烧可生成B,B具有漂白性,则B是二氧化硫,A是硫化氢,所以Y是S,X、Z是分别是氢气和氧气,二氧化硫与氯水反应生成硫酸和氯化氢,化学方程式为:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl.
点评 本题考查元素化合物的推断、电子式、离子方程式、化学方程式的书写、化学方程式的计算等,属于拼合型题目,是对学生综合能力的考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 原子序数 d>c>b>a | B. | 原子半径 A>B>D>C | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | B. | 1molEGC与3molNaOH恰好完全反应 | ||
| C. | 它具有酯的性质 | D. | 遇FeCl3溶液发生显色反应 |
①加H2O ②滴入几滴浓HNO3 ③滴入几滴浓盐酸 ④加少量硫酸铜固体 ⑤加NaCl固体 ⑥升高温度(不考虑盐酸挥发) ⑦改用10mL 0.1mol•L-1盐酸.
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
| A. | 过氧化钠 | B. | 臭氧 | C. | 二氧化硫 | D. | 过氧化氢 |
| A. | 把钠放入足量稀盐酸中 | |
| B. | 将钠用铝箔包好并刺些小孔,再放入水中 | |
| C. | 把钠放入硫酸铜溶液中 | |
| D. | 把钠放入足量水中 |
 ,ci2与ce2比较,沸点较高的是CS2(写分子式).
,ci2与ce2比较,沸点较高的是CS2(写分子式). 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):