题目内容
16.下列几种物质均能使品红褪色,其中有一种物质使品红褪色的原理与其他几种不同,该物质是( )| A. | 过氧化钠 | B. | 臭氧 | C. | 二氧化硫 | D. | 过氧化氢 |
分析 过氧化钠、臭氧、过氧化氢都具有强氧化性而使品红溶液褪色,二氧化硫和有色物质反应生成无色物质而使品红溶液褪色,据此分析解答.
解答 解:过氧化钠、臭氧、过氧化氢都具有强氧化性,它们的强氧化性导致品红溶液褪色,二氧化硫和有色物质化合生成不稳定的无色物质而使品红溶液褪色,所以二氧化硫的漂白性与其余三个选项的漂白性不同,故选C.
点评 本题考查物质的漂白性,为高频考点,明确漂白原理是解本题关键,注意二氧化硫漂白性具有暂时性特点,且二氧化硫不能使酸碱指示剂褪色.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
6.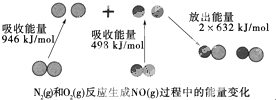 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O(g)反应生成NO(g)过程中的能量变化:下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
4.下列B组中命题正确且能用A组命题加以正确解释的是( )
| A组 | B组 |
| Ⅰ.H-I键键能大于H-Cl键键能 Ⅱ.H-I键键能小于H-Cl键键能 Ⅲ.HI分子间作用力大于HCl分子间作用力 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HI比HCl不稳定 ③HI沸点比HCl高 ④HI沸点比HCl低 |
| A. | Ⅰ、① | B. | Ⅳ、② | C. | Ⅲ、③ | D. | Ⅱ、④ |
11.足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为( )
| A. | 3:1 | B. | 3:2 | C. | 1:2 | D. | 6:1 |
1.已知某原子${\;}_{Z}^{A}$X的某能层电子排布为ns2np6nd5,下列说法中正确的是( )
| A. | 若n=4,则X是第四周期元素 | |
| B. | 若n=3,则Z可能等于25 | |
| C. | 若X是第四周期元素,则具有“ns2np6nd5”排布的原子一定只有2种 | |
| D. | 若n=4,则X的基态原子一定有10个s电子 |
8.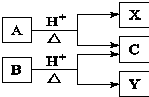 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
 有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )
有机物A与B均由C、H、O组成,A与B互为同分异构体,在酸性条件下均可水解,只生成两种有机物.转化关系如图所示.下列有关说法中正确的是( )| A. | X、Y一定互为同系物 | B. | X、Y的通式一定不同 | ||
| C. | X、Y可能互为同分异构体 | D. | X、Y一定互为同分异构体 |
5.铝粉和铁红的混合物分成两等份,一份直接放入足量的烧碱溶液中;另一份在高温下恰好完全反应,产物再与足量盐酸充分反应.则两种情况下生成的气体体积比(相同条件)是( )
| A. | 2:3 | B. | 3:2 | C. | 1:1 | D. | 2:1 |
6.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
(ⅰ)I2(g)+H2(g)?2HI(g)△H=-9.48kJ/mol
(ⅱ)I2(s)+H2(g)?2HI(g)△H=+26.48kJ/mol
下列判断正确的是( )
| A. | 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ | |
| B. | 1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | |
| C. | 反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 | |
| D. | 反应(ⅰ)的产物比反应(ⅱ)的产物稳定 |
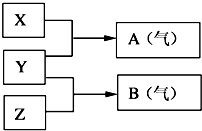 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W 同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.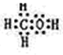 .
. .
.