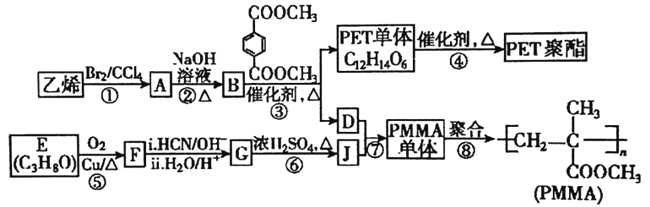
题目内容
【题目】甲醛在木材加工、医药等方面有重要用途。
I.利用甲醇(CH3OH)制备甲醛
脱氢法:CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJ·mol-1
氧化法:CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) △H2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有____________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)已知:2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJ·mol-1,则△H2=________。
(3)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→·H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过5min反应,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),回答下列问题:
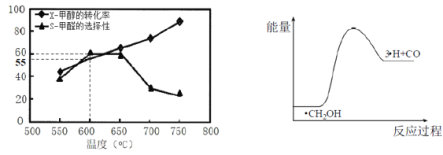
①600℃时,5min内甲醛的反应速率为____________。
②650℃-750℃甲醛选择性随温度下降,而甲醇转化率随温度升高的可能原因为________;
③700℃时,历程iii能量~反应过程如图所示,在答卷纸上绘制历程ii的“能量~反应过程”示意图。___________
II.室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理所示,则工作电极的电极反应式为_____________。

【答案】BC -149.73kJ·mol-1 50.5kPa 0.066mol·L-1·min-1 反应CH3OHCO+2H2为吸热反应,温度升高平衡正移,CH3OH转化率提高;或该反应随温度升高反应速率加快,CH3OH转化率提高 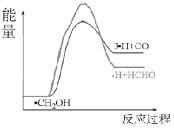 HCHO-4e-+H2O=CO2+4H+
HCHO-4e-+H2O=CO2+4H+
【解析】
I.(1)该反应是一个反应前后气体体积增大的吸热反应,减小压强、升高温度都能增大反应物转化率;
(2)根据盖斯定律分析解答;
(3)恒温恒容条件下,压强之比等于其物质的量之比,根据方程式,结合甲醇的转化率计算平衡时的压强和三种气体分压,再结合反应的平衡常数Kp=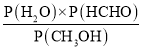 计算;
计算;
(4)①600℃时,5min内甲醇的转化率为55%,根据C原子守恒得n(HCHO) =n(CH3OH)(消耗)×60%=1mol×55%×60%=0.33mol,据此计算v(HCHO);②升高温度平衡向吸热方向移动;③ii为分解反应,是吸热反应,H原子和CO生成甲醛的反应为放热反应,所以反应ii产物总能量小于反应iii产物总能量;
II.反应中C元素化合价由0价变为+4价,则工作电极为负极,负极上HCHO失电子发生氧化反应。
I.(1) 脱氢法制甲醛的反应为CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJ·mol-1,该反应是一个反应前后气体体积增大的吸热反应,减小压强、升高温度都能使平衡正向移动,从而增大反应物转化率,所以提高平衡产率的条件为高温、低压,故选BC;
(2)i.CH3OH(g)HCHO(g)+H2(g) △H1=+92.09kJmol-1,ii.2H2(g)+O2(g)=2H2O(g) △H3=-483.64kJmol-1,根据盖斯定律,将方程式i+![]() ii得方程式CH3OH(g)+
ii得方程式CH3OH(g)+![]() O2(g)HCHO(g)+H2O(g) △H2=(+92.09-
O2(g)HCHO(g)+H2O(g) △H2=(+92.09-![]() ×483.64)kJ/mol=-149.73kJmol-1,故答案为:-149.73kJmol-1;
×483.64)kJ/mol=-149.73kJmol-1,故答案为:-149.73kJmol-1;
(3)恒温恒容条件下,压强之比等于其物质的量之比,设开始时n(CH3OH)=amol,达到平衡状态时甲醇的转化率为50%,则平衡时n(CH3OH)=amol×(1-50%)=0.5amol,根据方程式CH3OH(g)HCHO(g)+H2(g)知,平衡时生成的n(HCHO)=n(H2)=0.5amol,则平衡时混合气体总物质的量=(0.5+0.5+0.5)amol=1.5amol,平衡时压强P=![]() ×101kPa=1.5×101kPa,三种气体分压相等,P(CH3OH)=P(HCHO)=P(H2O)=
×101kPa=1.5×101kPa,三种气体分压相等,P(CH3OH)=P(HCHO)=P(H2O)=![]() ×1.5×101kPa=0.5×101kPa,反应的平衡常数Kp=
×1.5×101kPa=0.5×101kPa,反应的平衡常数Kp=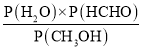 =
=![]() =50.5kPa,故答案为:50.5kPa;
=50.5kPa,故答案为:50.5kPa;
(4)①600℃时,5min内甲醇的转化率为55%,根据C原子守恒得n(HCHO)=n(CH3OH)(消耗)×60%=1mol×55%×60%=0.33mol,v(HCHO)= =0.066 molL-1min-1,故答案为:0.066 molL-1min-1;
=0.066 molL-1min-1,故答案为:0.066 molL-1min-1;
②升高温度平衡向吸热方向移动,反应CH3OHCO+2H2为吸热反应,温度升高平衡正移,CH3OH转化率提高;或该反应随温度升高反应速率加快,CH3OH转化率提高,故答案为:反应CH3OHCO+2H2为吸热反应,温度升高平衡正移,CH3OH转化率提高;或该反应随温度升高反应速率加快,CH3OH转化率提高;
③ii为分解反应,是吸热反应,H原子和CO生成甲醛的反应为放热反应,所以反应ii产物总能量小于反应iii产物总能量,所以其图像为 ,故答案为:
,故答案为: ;
;
II.根据工作原理图,反应中HCHO 中C元素化合价由0价变为+4价,则工作电极为负极,负极上HCHO失电子发生氧化反应,电极反应式为HCHO-4e-+H2O=CO2+4H+,故答案为:HCHO-4e-+H2O=CO2+4H+。

【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是

① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D