题目内容
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法正确的是( )
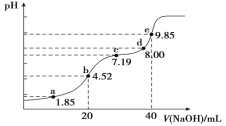
A.a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1 mol/L
B.b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C.c点所得溶液中:c(Na+)>3c(HSO3-)
D.d点所得溶液中:c(Na+)>c(OH-) >c(SO32-)
【答案】C
【解析】
A、 a点溶液pH= 1.85, 即pH= pKa1,所以溶液中c(H2SO3)= c(HSO3-),根据物料守恒:c(SO32-)+( HSO3-)+c(H2SO3)=![]() ,由于c(H2SO3)= c(HSO3-),所以2c(HSO3-)+c(SO32-)=
,由于c(H2SO3)= c(HSO3-),所以2c(HSO3-)+c(SO32-)=![]() ,故A错误;
,故A错误;
B,b点加入KOH溶液的体积为20mL,恰好反应生成NaHSO3,根据质子守恒:c(H+) + c(H2SO3)= c(SO32-)+c(OH-),故B错误;
C、c点溶液pH= 7.19, 即pH= pKa2,所以溶液中c(HSO3-)= c(SO32-),溶液为碱性,溶液中c(H+)<c(OH- ),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH- )+c(HSO3-) + 2c(SO32-),由于c(HSO3- ) = c(SO32-), 所以c(Na+)+c(H+)=c(OH-) + 3 c(HSO3-),又由于c(H+)< c(OH-),所以c(Na+)> 3 c(HSO3-),故C正确;
D、d点加入NaOH溶液体积为40mL,恰好反应生成Na2SO3,Na2SO3水解,水解是微弱的,故c(SO32-)>c(OH-) ,故D错误;
答案选C。

【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
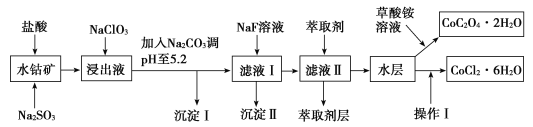
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]