题目内容
【题目】已知:① CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
② R-CH=CH2![]() R-CH2-CH2-Br
R-CH2-CH2-Br
香豆素的核心结构是芳香内酯A,A经下列步骤转变为水杨酸。
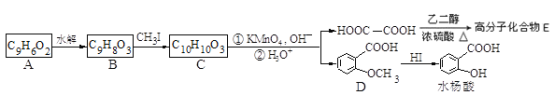
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是___________
a. C中核磁共振氢谱共有8种峰
b. A、B、C均可发生加聚反应
c. 1mol A最多能和5mol氢气发生加成反应
d. B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为______和______(填官能团名称),B→C的反应类型为_____________。
(3)在上述转化过程中,反应步骤B→C的目的是_________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:_____________。
(5)写出合成高分子化合物E的化学反应方程式:_______________________________。
【答案】c 羧基 羟基 取代反应 为了保护酚羟基使之不被氧化 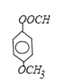 、
、![]() 、
、 (任选一种即可)
(任选一种即可) 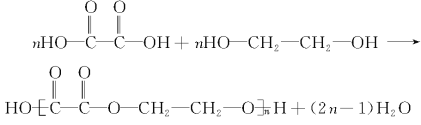
【解析】
根据转化图结合逆合成分析法可知,C被高锰酸钾氧化生成乙二酸和D,结合题给信息及C的分子式知,C的结构简式为![]() 。B和一碘甲烷发生取代反应生成C,所以根据C的结构简式可判断B的结构简式为
。B和一碘甲烷发生取代反应生成C,所以根据C的结构简式可判断B的结构简式为![]() 。A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:
。A水解生成B,且A的分子式为C9H6O2,A和B相对分子质量相差18,所以A的结构简式为:![]() 。D和碘化氢发生取代反应生成水杨酸,据此分析作答。
。D和碘化氢发生取代反应生成水杨酸,据此分析作答。
(1)根据上述分析易知,A为![]() ;B为
;B为![]() ;C为
;C为![]() ,则
,则
a. C中有8种不同环境的H原子,故核磁共振氢谱共有8种峰,a项正确;
b. A、B、C分子中均有碳碳双键,均可发生加聚反应,b项正确;
c. A中含碳碳双键和酯基,酯基不能发生加成反应,则1mol A最多能和4mol氢气发生加成反应,c项错误;
d. B中含苯环,酚羟基的邻、对位能与浓溴水发生取代反应,d项正确;
故答案为c;
(2) B为![]() ,含氧官能团的名称为:羧基和羟基;C为
,含氧官能团的名称为:羧基和羟基;C为![]() ,B→C为取代反应;
,B→C为取代反应;
(3)因酚羟基易被氧化,因此B→C发生取代反因的目的是为了保护酚羟基使之不被氧化;
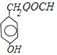
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,说明含有两个取代基,能水解说明含有酯基,且水解后生成的产物之一能发生银镜反应,说明含有醛基,所以符合条件的同分异构体有 、
、![]() 、
、 ,所以共有3种;
,所以共有3种;
(5)乙二酸与乙二醇在浓硫酸催化作用下发生缩聚反应生成聚乙二酸乙二酯,其化学方程式为: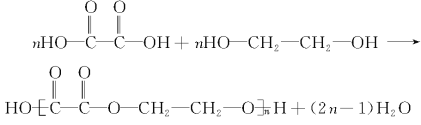

 培优口算题卡系列答案
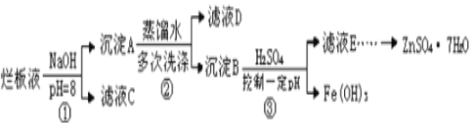
培优口算题卡系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
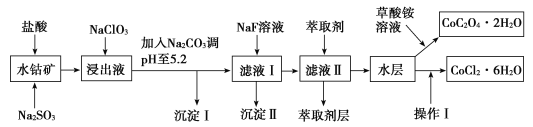
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]