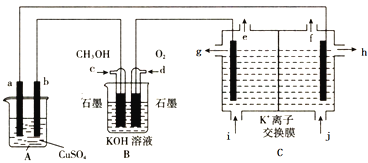
题目内容
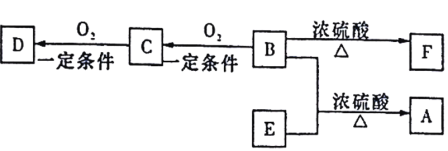
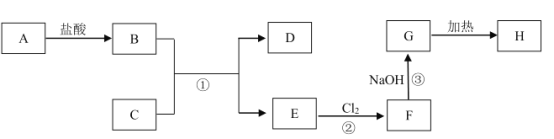
【题目】中学化学中几种常见物质的转化关系如图所示(部分生成物已略去)。其中,A为黑色固体;C、D为金属单质,且D为红色;H为红棕色粉末,常用作红色油漆和涂料。
(1)写出物质H的化学式:___。
(2)写出下列反应的离子方程式:反应②___,反应③___。
(3)向E溶液中滴入NaOH溶液时,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色。写出沉淀由白色变成红褐色的化学方程式:___。
(4)印刷电路板是由高分子材料和金属D复合而成的。刻制印刷电路时,要用过量的F溶液作为“腐蚀液”,其在刻制过程中作___(填“氧化”或“还原”)剂,写出该反应的离子方程式:___。
(5)某同学通过实验实现了反应F→E的转化,为了检验F是否完全转化为E,设计如下实验方案:取少量F于试管中,加水溶解,并滴加KSCN溶液,再向其中加入粉末C,振荡。当观察到___现象时,证明F完全转化为E。
【答案】Fe2O3 2Fe2++Cl2=2Fe3++2Cl- Fe3++3OH-=Fe(OH)3↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 氧化 Cu+2Fe3+=2Fe2++Cu2+ 红色褪去
【解析】
H为红棕色粉末,常用作红色油漆和涂料,可推知H为Fe2O3;G加热生成H,则G为氢氧化铁;E与氯气反应生成F,F与氢氧化钠反应生成氢氧化铁,则E为氯化亚铁,F为氯化铁;C、D为金属单质,且D为红色,则D为Cu,E为氯化亚铁则C为Fe;A为黑色固体,与盐酸反应生成B,B为氯化铜,则A为氧化铜。
(1)综上分析,H为氧化铁,化学式为Fe2O3。
(2)反应②中氯化亚铁与氯气发生反应生成氯化铁,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;反应③中氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,离子方程式为Fe3++3OH-=Fe(OH)3↓。
(3)向氯化亚铁溶液中滴入NaOH溶液时,生成的白色絮状沉淀Fe(OH)2,氢氧化亚铁极易被空气中的氧气氧化,发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,故白色沉淀迅速变成灰绿色,最后变成红褐色。
(4)刻制印刷电路时,要用过量的氯化铁溶液作为“腐蚀液”,氯化铁溶液与金属铜反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+,其中铁元素化合价降低,故氯化铁在刻制过程中作氧化剂。
(5)为了检验氯化铁是否完全转化为氯化亚铁,取少量氯化铁溶液于试管中,加水溶解,并滴加KSCN溶液,铁离子遇KSCN溶液变红,再向其中加入铁粉,振荡,发生反应Fe+2Fe3+=3Fe2+,故当观察到红色褪去时,证明F完全转化为E。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案