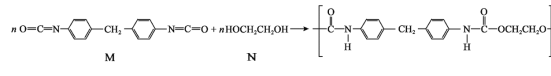
题目内容
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
【答案】放出92该反应是可逆反应,1 mol N2和3 mol H2不能完全反应,因此放出能量总是小于92 kJ0.25acf
【解析】
(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则反应的N2+3H2![]() 2NH3的ΔH=(946+436×3-391×6)kJ/mol=-92kJ/mol,所以若1mol N2完全反应生成NH3可放出热量92kJ。
2NH3的ΔH=(946+436×3-391×6)kJ/mol=-92kJ/mol,所以若1mol N2完全反应生成NH3可放出热量92kJ。
(2)由于该反应是可逆反应,1 mol N2和3 mol H2不能完全反应生成2mol氨气,因此放出能量总是小于92 kJ。
(3)在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则消耗氮气5mol,浓度是2.5mol/L,用N2表示的化学反应速率是2.5mol/L÷10min=0.25 mol·L -1·min-1。
(4)a.达到化学平衡时,正反应速率和逆反应速率一定相等,a正确;
b.达到化学平衡时,正反应速率和逆反应速率一定相等,且均不为0,b错误;
c.达到化学平衡时,即达到反应最大限度,N2的转化率达到最大值,c正确;
d.达到化学平衡时,N2和H2的浓度不再改变,但不一定相等,d错误;
e.达到化学平衡时,N2、H2和NH3的体积分数不变,但不一定相等,e错误;
f.达到化学平衡时,反应达到最大限度,f正确。
答案选acf。

 习题精选系列答案
习题精选系列答案