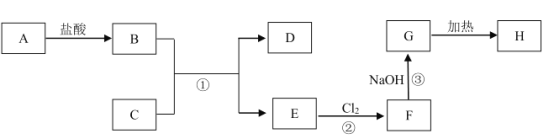
题目内容
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为___________________,其中C原子的杂化形式是_____________。
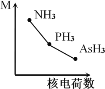
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306 ℃,而FeF3晶体熔点高于1000 ℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
(4)结合下表数据,所得结论:I1(Cu)<I1(Fe),而I2(Cu)>I2(Fe)。请用所学理论解释:________________________________________。

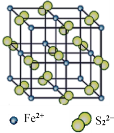
(5)“愚人金”是铁硫化合物,其晶体的晶胞如上右图所示。该晶体的化学式为______________。
【答案】离子键、共价键、配位键 [:C![]() N:]- sp杂化 F>O>As 稳定性、R—H键能 F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体 主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,能量较低,此时再失去第二个电子即3d10中的1个电子所需能量较大(或Fe电子排布式为[Ar]3d64s2,失去一个电子变为[Ar]3d64s1,此时再失去第二个电子即4s1中的电子所需能量较小) FeS2
N:]- sp杂化 F>O>As 稳定性、R—H键能 F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体 主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,能量较低,此时再失去第二个电子即3d10中的1个电子所需能量较大(或Fe电子排布式为[Ar]3d64s2,失去一个电子变为[Ar]3d64s1,此时再失去第二个电子即4s1中的电子所需能量较小) FeS2
【解析】
(1)配合物中主要含有离子键、共价键、配位键;因CN-各原子均满足8电子稳定结构,故CN-的电子式为[:C![]() N:]-;根据VSEPR模型计算C原子的杂化类型为sp杂化;
N:]-;根据VSEPR模型计算C原子的杂化类型为sp杂化;
(2)原子的电负性同一周期从左到右依次增大、同一主族从上到下依次减小,故F、O、As的电负性从大到小为F>O>As;因N、P、As三者的非金属性一次减弱,故M可能是稳定性或者R-H键能;
(3)F的电负性较强,FeCl3为分子晶体,微粒之间的作用力是分子间作用力,FeF3位离子键晶体,微粒之间的作用力是离子键,故FeF3的熔点较高;
(4)主要原因是Cu电子排布式为[Ar]3d104s1,失去一个电子变为[Ar]3d10,此时3d能级全满,较稳定能量较低,此时再失去第二个电子需要较大的能量;
(5)从晶体结构中可以看出,Fe2+分布在8个定点和6个面心,故晶胞中含有![]() =4个Fe2+,S22-分布在12条棱和体心上,故晶胞中含有
=4个Fe2+,S22-分布在12条棱和体心上,故晶胞中含有![]() =4个S22-,故分子式为FeS2。
=4个S22-,故分子式为FeS2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案