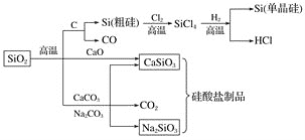
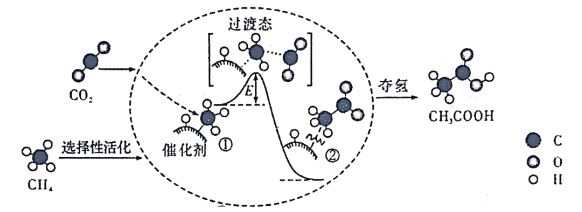
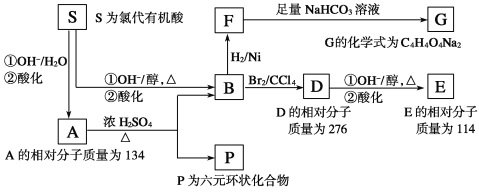
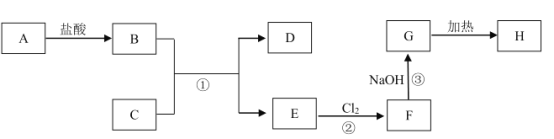
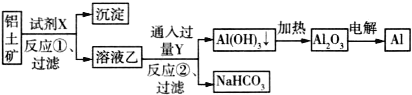
��Ŀ����
����Ŀ���±��г��ˢ١���ʮ��Ԫ�������ڱ��е�λ�ã�
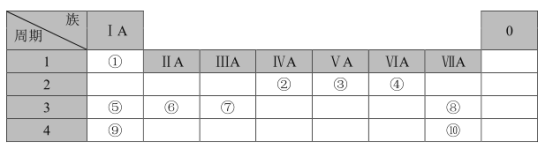
�밴Ҫ��ش��������⣺
��1��Ԫ�آݵ�ԭ�ӽṹʾ��ͼΪ___��Ԫ�آڵ����������ĵ���ʽ��___��
��2���ݡ��ޡ�������Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����___����Ԫ�ط��ţ���������Ԫ������������Ӧˮ�����м�����ǿ����___���ѧʽ����
��3���ۡ���Ԫ�صļ��⻯����ȶ��Խ�������___���ѧʽ����
��4���١��ڡ�������Ԫ���γɵ��л���ķ��ӽṹģ����ͼ��ʾ��д�����л���Ľṹ��ʽ��___����������γɵ����ϩ����������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ��___��

��5��Ԫ�آߵ�����������Ӧ��ˮ����������������Һ��Ӧ�����ӷ���ʽ��___��
��6��д��Ԫ�آ�ĵ�����ˮ��Ӧ�Ļ�ѧ����ʽ��___��
��7�����ԭ�ӽṹ�ĽǶȽ��ͣ�Ԫ�آ�ǽ����Ա�Ԫ�آ�ǿ��ԭ��___��
���𰸡�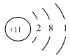
![]() K>Na>Mg KOH NH3 CH3CH2OH CH2=CH2+Br2��CH2BrCH2Br Al(OH)3+OH-=AlO
K>Na>Mg KOH NH3 CH3CH2OH CH2=CH2+Br2��CH2BrCH2Br Al(OH)3+OH-=AlO![]() +2H2O 2K+2H2O=2KOH+H2�� Cl��Br��ͬһ���壬Cl��Br���Ӳ�����һ�㣬Clԭ�Ӱ뾶С���õ�������ǿ����˷ǽ�����ǿ��Br
+2H2O 2K+2H2O=2KOH+H2�� Cl��Br��ͬһ���壬Cl��Br���Ӳ�����һ�㣬Clԭ�Ӱ뾶С���õ�������ǿ����˷ǽ�����ǿ��Br
��������
����Ԫ�����ڱ��ṹ��֪�٢ڢۢܢݢޢߢ���ֱ�Ϊ��H��C��N��O��Na��Mg��Al��Cl��K��Br���ݴ˽��
(1)Ԫ�آ�(Na)��ԭ�ӽṹʾ��ͼΪ ��Ԫ�آ�(C)�����������ΪCO2�������ʽΪ��
��Ԫ�آ�(C)�����������ΪCO2�������ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��![]() ��
��
(2)���Ӳ���Խ�࣬ԭ�Ӱ뾶Խ���Ӳ�����ͬ���˵����Խ��ԭ�Ӱ뾶ԽС�����Ԣ�(Na)����(Mg)����(K)ԭ�Ӱ뾶�ɴ�С��˳��ΪK>Na>Mg��ͬ����Ԫ�ش��ϵ��½�������ǿ��ͬ����Ԫ�ش������ҽ����Լ��������Խ����ԣ�K>Na>Mg��������Խǿ������������Ӧˮ�������Խǿ�����Լ��ԣ�KOH��ǿ���ʴ�Ϊ��K>Na>Mg��KOH��
(3)�ǽ����ԣ���(N)����(O)���ǽ�����Խǿ�����⻯����ȶ���Խ�ã����Լ��⻯����ȶ��ԣ�NH3�������ʴ�Ϊ��NH3��
(4)���ݸ��л���ķ��ӽṹģ�Ϳ�֪�����л���Ľṹ��ʽΪCH3CH2OH����������γɵ����ϩ����CH2=CH2������������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ��CH2=CH2+Br2��CH2BrCH2Br���ʴ�Ϊ��CH3CH2OH��CH2=CH2+Br2��CH2BrCH2Br��
(5)Ԫ�آ�(Al)������������Ӧ��ˮ����������������Һ��Ӧ�����ӷ���ʽΪ��Al(OH)3+OH-=AlO![]() +2H2O���ʴ�Ϊ��Al(OH)3+OH-=AlO
+2H2O���ʴ�Ϊ��Al(OH)3+OH-=AlO![]() +2H2O��
+2H2O��
(6)Ԫ�آ�(K)�ĵ���(K)��ˮ��Ӧ�Ļ�ѧ����ʽΪ��2K+2H2O=2KOH+H2�����ʴ�Ϊ��2K+2H2O=2KOH+H2����
(7)Ԫ�آ�(Cl)�ǽ����Ա�Ԫ�آ�(Br)ǿ��ԭ���ǣ�Cl��Br��ͬһ���壬Cl��Br���Ӳ�����һ�㣬Clԭ�Ӱ뾶С���õ�������ǿ����˷ǽ�����ǿ��Br���ʴ�Ϊ��Cl��Br��ͬһ���壬Cl��Br���Ӳ�����һ�㣬Clԭ�Ӱ뾶С���õ�������ǿ����˷ǽ�����ǿ��Br��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�