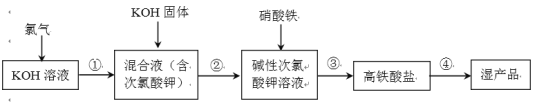
题目内容
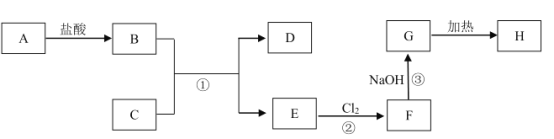
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如图:

(1)第①步加稀H2SO4时,粗MnO2样品中的__(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是_Mn2++_ClO3-+_H2O=_MnO2↓+_Cl2↑+_H+。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、__、__,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有__(写化学式)
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要__molNaClO3。
【答案】MnO、MnCO3 5 2 4 5 1 8 蒸发皿 玻璃棒 NaCl 0.02
【解析】
由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3、MnO和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4;根据电子守恒可配平第②步发生的离子方程式:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,第③步中氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体。
(1)由制备流程可知,只有MnO2不与硫酸反应,则MnO和MnCO3转化为可溶性物质;
(2)MnSO4要转化为MnO2,要失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;
(3)第③步属于蒸发,所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂,NaClO3属于氧化产物,因此一定有还原产物NaCl;
(5)由题意知样品中的MnO和MnCO3质量为12.69g-8.7 g=3.99g,且收集到0.224LCO2(标准状况下)为0.01mol,由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为:2.84g/(71g·mol-1)=0.04mol,因此MnO和MnCO3与稀硫酸反应时共生成MnSO4的物质的量为0.05mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.02mol。