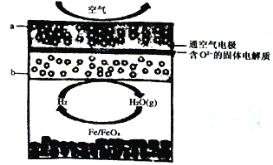
题目内容
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______。
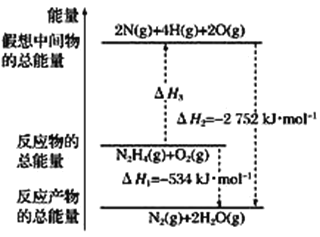
(2)已知:
甲醇脱水反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应:2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应:CH3CH2OH(g)=CH3OCH3(g) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应 C2H4 (g)+H2O(g)C2H5OH(g)的△H=_______kJ·mol-1。与间接水合法相比,气相直接水合法的优点是______
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系:(其中nH2O:nC2H4=1:1)
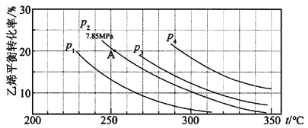
①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强 P1、P2、P3、P4 的大小顺序为_______,理由是_______。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290 ℃,压强 6.9MPa, n H2 O ︰ nC2 H4 =0.6︰1。乙烯的转化率为 5℅,若要进一步提高乙烯的转化率, 除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
【答案】C2H4+H2SO4(浓)→C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4 45.5 污染小、腐蚀性小等 0.0717(MPa)1 P1<P2<P3<P4 反应分子数减少,相同温度下,压强升高,乙烯转化率提高 将产物乙醇液化移去 增加nH2O:nC2H4比
【解析】
(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),效仿乙酸乙酯水解,将水分成氢原子和羟基生成乙醇和硫酸;(2)利用盖斯定律构造目标热化学方程式并求焓变,气相直接水合法污染小、腐蚀性小、原子利用率100%;(3)①列出Kp表达式,利用三段法计算平衡分压带入表达式计算即可;②在相同温度下由于乙烯转化率为P1<P2<P3<P4,由C2H4(g)+H2O(g)C2H5OH(g)可知正反应为气体体积减小的反应,根据压强对平衡移动的影响分析;③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度。
(1)乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),化学方程式为C2H4+H2SO4(浓)→C2H5OSO3H,硫酸氢乙酯水解生成乙醇和硫酸,化学方程式为C2H5OSO3H+H2O→C2H5OH+H2SO4,故答案为:C2H4+H2SO4(浓)→C2H5OSO3H、C2H5OSO3H+H2O→C2H5OH+H2SO4;
(2)甲醇脱水反应①2CH3OH(g)═CH3OCH3(g)+H2O (g) △H1=23.9kJmol1
甲醇制烯烃反应②2CH3OH(g)═C2H4(g)+2H2O(g) △H2=29.1kJmol1
乙醇异构化反应③C2H5OH(g)═CH3OCH3(g) △H3=+50.7kJmol1
根据盖斯定律①②③可得:C2H4(g)+H2O(g)C2H5OH(g) △H=(23.9+29.150.7)kJ/mol=45.5kJ/mol;间接水合法时使用了浓硫酸,浓硫酸具有强腐蚀性和强氧化性,在制乙醇的过程中会发生氧化还原反应产生大气污染物,乙烯直接水合法中反应物中所有原子全部都变成生成物,所以原子利用率100%,故答案为:45.5;污染小、腐蚀性小等;
(3)①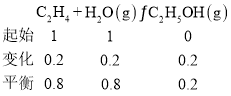
乙醇占![]() ,乙烯和水各占
,乙烯和水各占![]() ,则乙醇的分压为7.85MPa×
,则乙醇的分压为7.85MPa×![]() =0.87Mpa,乙烯和水的分压为7.85MPa×
=0.87Mpa,乙烯和水的分压为7.85MPa×![]() =3.49MPa,所以
=3.49MPa,所以![]() ,故答案为:0.0717(MPa)1;
,故答案为:0.0717(MPa)1;
②在相同温度下由于乙烯转化率为P1<P2<P3<P4,由C2H4(g)+H2O(g)C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是P1<P2<P3<P4,故答案为:P1<P2<P3<P4;反应分子数减少,相同温度下,压强升高乙烯转化率提高;
③若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等,
故答案为:将产物乙醇液化移去;增加nH2O:nC2H4比。

 阅读快车系列答案
阅读快车系列答案【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |
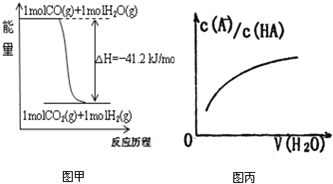
A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,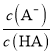 的变化情况
的变化情况
【题目】将绿矾(FeSO47H2O)隔绝空气条件下加强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
(实验一)为探究固体产物中铁元素的价态,该同学将固体产物溶于足量的稀硫酸得到相应的溶液,进行以下猜想和实验:
猜想 | 实验操作 | 预期现象 |
猜想一:铁元素只显_______价 | ① 取溶液样品,滴入KSCN溶液;②取溶液样品,滴入稀酸性KMnO4溶液 | 加入KSCN溶液无明显现象稀酸性KMnO4溶液颜色______ |
猜想二:铁元素只显_______价 | 加入KSCN溶液呈______色;稀酸性KMnO4溶液颜色无变化 | |
猜想三:铁元素显+2,+3价 | 加入KSCN溶液呈血红色;稀酸性KMnO4溶液颜色褪色 |
(实验二)为进一步探究该反应的产物,进行了如下图所示的实验:
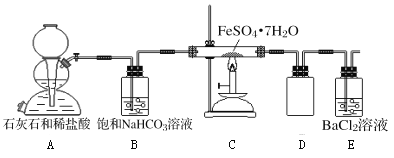
(1)实验开始时,点燃C处酒精喷灯之前应先打开A处活塞通CO2,其目的是_________。
(2)饱和NaHCO3的作用是______,其水溶液呈碱性的原因(用离子方程式解释)____________。
(3)该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,E瓶中只出现白色沉淀且质量为23.3克;C中固体产物加入足量稀硫酸中,固体产物全部溶解,取溶液样品,加入KSCN,溶液呈血红色,取另一份溶液,加入酸性KMnO4,不褪色。根据这些实验现象和数据,可以得知绿矾分解的化学方程式为____________________________。
(4)该组同学设计的装置存在着一个明显的缺陷是__________________________。