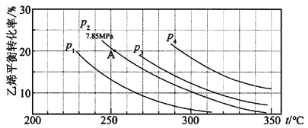
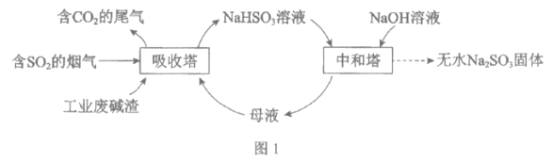
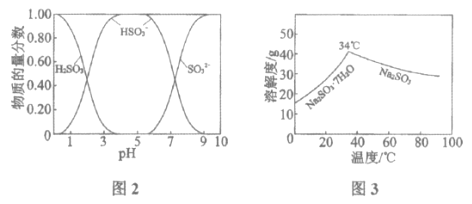
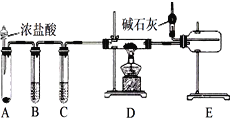
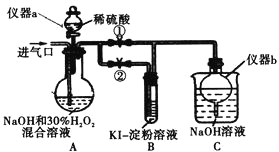
题目内容
【题目】H2O2是一种二元弱酸,对于0.1mol·L1的过氧化氢溶液,下列叙述不正确的是()
A.H2O2的电离方程式可写作H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O22-
H++O22-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
【答案】B
【解析】
A. H2O2为二元弱酸,它发生部分电离,且分步进行,每步只电离出一个H+,A正确;
B. 加水稀释过程中,K1(H2O2)不变,α(H2O2)增大,c(H+)减小,B不正确;
C. 加入少量浓盐酸,增大了溶液中的c(H+),过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动,C正确;
D.氯化铁溶液是H2O2分解的催化剂,能加快H2O2分解速率,所以溶液中产生大量气泡,D正确。
故选B。

练习册系列答案
相关题目