题目内容
【题目】Ⅰ.(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为________,写出肼(l)和N2O4(l)反应的热化学方程式:___________________________________________________。
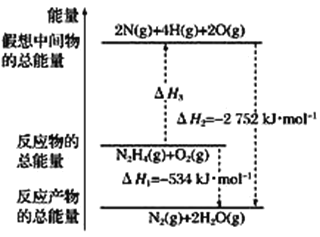
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是________ kJ。
【答案】= 436.5 kJ 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1 391
【解析】
(1)反应热与反应物的总能量和生成物的总能量有关,与反应条件无关;
(2)运用盖斯定律进行分析;
(3)根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可.
(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同;
故答案为:=;
(2)已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
②×2-①得:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1,有热化学方程式可知消耗2mol的N2H4(l)放出873KJ的热量,故1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为436.5 kJ,
故答案为:436.5 kJ;2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH=-873 kJ·mol-1
(3)根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g),△H3=2752kJ/mol534kJ/mol=2218kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,设断裂1molNH键所需的能量为K,旧键断裂吸收的能量:154+4K+500=2218,解得K=391,
故答案为:391。

 阅读快车系列答案
阅读快车系列答案