题目内容
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
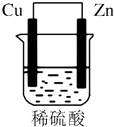
D. 若在原电池中进行,反应放出的热量不变
【答案】B
【解析】试题分析:A.催化剂虽然改变了反应途径,反应物、生成物的状态不变,所以△H不变,A错误;B.反应前后体积不变,则改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变,B正确;C.该反应是放热反应,升高温度,化学反应速率加快,反应的△H不变,但由于平衡向逆反应方向进行,放出的热量减少,C错误;D.若在原电池中进行,反应不放出热量,而是将化学能转换为电能,D错误;答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:

①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol/L,则平衡时CO2的浓度为________mol/L。
②下列措施中能使平衡时CO物质的量百分数增大的是________(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是______。
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的v逆变化曲线_________________________。