题目内容
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1
FeO(s)+CO(g) ΔH1,平衡常数为K1
反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2
FeO(s)+H2(g) ΔH2,平衡常数为K2
在不同温度时K1、K2的值如下表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH,平衡常数为K,则ΔH=_______(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图1所示:

①该条件下反应的平衡常数为___________;若铁粉足量,CO2的起始浓度为2.0 mol/L,则平衡时CO2的浓度为________mol/L。
②下列措施中能使平衡时CO物质的量百分数增大的是________(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
(3)对于可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
FeO(s)+CO(g),该反应的逆反应速率随时间变化的关系如图2。
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是______。
A.升温 B.增大CO2浓度 C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的v逆变化曲线_________________________。
【答案】 ΔH1-ΔH2 K1/K2 吸热 2 0.67 A B 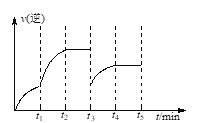
【解析】(1)由盖斯定律,已知中第一个反应减第二个反应可得反应CO2(g)+H2(g)![]() CO(g)+H2O(g),所以△H=△H1-△H2,K=
CO(g)+H2O(g),所以△H=△H1-△H2,K=![]() ;由不同温度时K1、K2的值可计算出,700℃时K=
;由不同温度时K1、K2的值可计算出,700℃时K=![]() ,900℃时K=
,900℃时K=![]() ,所以随着温度的升高,K值增大,正反应是吸热反应。
,所以随着温度的升高,K值增大,正反应是吸热反应。
(2)①根据图1的数据列三段式得:
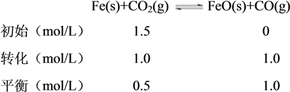
所以K=![]() =
=![]() =2;若铁粉足量,CO2的起始浓度为2.0 mol/L,平衡时CO2的浓度为x,列三段式得:
=2;若铁粉足量,CO2的起始浓度为2.0 mol/L,平衡时CO2的浓度为x,列三段式得:
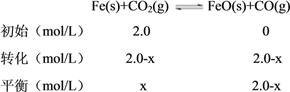
因为温度没变,所以K没变,列式得: ![]() =2,解得x=
=2,解得x=![]() ≈0.67,所以平衡时CO2的浓度为0.67mol/L。
≈0.67,所以平衡时CO2的浓度为0.67mol/L。
②A项,因为正反应吸热,所以升高温度,平衡右移,CO物质的量百分数增大,故A正确;B项,因为左右两边气体分子数相等,所以增大压强平衡不移动,故B错误;C项,增加CO2,尽管平衡右移,但根据勒沙特列原理,再次平衡时必然导致![]() 变小,故C错误;D项,铁粉为固体,不影响平衡的移动,故D错误。
变小,故C错误;D项,铁粉为固体,不影响平衡的移动,故D错误。
(3)①从图中看出,在t1时改变了条件,没有使逆反应速率瞬间增大,是在原来基础上逐渐增大,在t2时达平衡,因为升温和使用催化剂都会使逆反应速率瞬间增大而发生突变,增大CO2浓度,正反应速率瞬间变大,逆反应速率逐渐增大,所以A和C错误,B正确。②如果在t3时从混合物中分离出部分CO,物质的量浓度减小,反应速率减小,平衡向正反应方向移动,逆反应速率瞬间减小,然后逐渐增大,t4时不再变化,t4~t5时间段反应处于新平衡状态,所以t3~t5的v逆变化曲线为: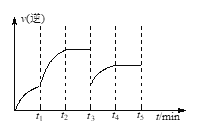 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案