��Ŀ����
����Ŀ����ͭƬ��пƬ��200mLϡH2SO4��ɵ�ԭ����У���ͼ��ʾװ�ã����밴Ҫ����գ�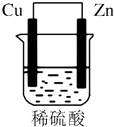
��1��Ϊ������������Ӧ������������ԭ������������ �� �缫��ӦʽΪ��Ϊ������������Ӧ������������ԭ������������ �� �缫��ӦʽΪ ��
��2��H+�����ƶ���������������Ϊ�����ߡ�����缫���ϣ�
��3����пƬֻ�����绯ѧ��Ӧ����ͭƬ�Ϲ��ų�3.36L����״��������ʱ��H2SO4ǡ����ȫ���ģ���
�ٷ�Ӧ�����ĵ�п������
����������ͨ���˵��ߣ�
��ԭϡH2SO4�����ʵ���Ũ���� ��
���𰸡�
��1��Cu����ԭ�����������ɣ�2H++2e���TH2����Zn��������п���ܽ⣻Zn��2e���TZn2+
��2��Cu��Zn��Cu
��3��9.75g��0.3NA��1.5mol/L
���������⣺��1���γ�ԭ���ʱ��ͭΪԭ���������������ԭ��Ӧ���缫����ʽΪ2H++2e���TH2������Cu�����������ɣ�пΪ���������ܽ⣬пʧ���ӷ���������Ӧ���缫����ʽΪZn��2e���TZn2+ �� ���Դ��ǣ�Cu����ԭ�����������ɣ�2H++2e���TH2����Zn��������п���ܽ⣻Zn��2e���TZn2+����2��CuΪ������ZnΪ��������Һ���������������ƶ��������ɸ�����������������Zn������Cu�������Դ��ǣ�Cu��Zn��Cu����3��ͭ�缫����ʽΪ2H++2e���TH2����n��H2��= ![]() =0.15mol��ת��0.3mol���ӣ�����֪�缫����ʽΪZn��2e���TZn2+ �� ת��0.3mol���ӣ�����0.15molп�������ĵ�пΪ0.15mol��65mol/L=9.75g�����Դ��ǣ�9.75g����ת�Ƶĵ�����Ϊ0.3NA�������Դ��ǣ�0.3NA����������ȫ���ģ���n��H2��=n��H2SO4������ԭ����������ʵ���Ϊ0.15mol��
=0.15mol��ת��0.3mol���ӣ�����֪�缫����ʽΪZn��2e���TZn2+ �� ת��0.3mol���ӣ�����0.15molп�������ĵ�пΪ0.15mol��65mol/L=9.75g�����Դ��ǣ�9.75g����ת�Ƶĵ�����Ϊ0.3NA�������Դ��ǣ�0.3NA����������ȫ���ģ���n��H2��=n��H2SO4������ԭ����������ʵ���Ϊ0.15mol��
����ԭ��������ʵ���Ũ����c= ![]() =
= ![]() =0.75mol/L�����Դ��ǣ�0.75mol/L��
=0.75mol/L�����Դ��ǣ�0.75mol/L��

 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�