题目内容
8.已知75mL 2mol/L NaOH溶液的质量为80g,则溶液中溶质的质量分数是多少?分析 依据n=c×V计算出氢氧化钠的物质的量,然后计算出氢氧化钠的质量,最终计算氢氧化钠的质量分数即可.
解答 解:75mL 2mol/L NaOH中,氢氧化钠的物质的量为:0.075L×2mol/L=0.15mol,故氢氧化钠的质量为:0.15mol×40g/mol=6g,
故质量分数为:$\frac{6g}{80g}$×100%=7.5%,
答:溶液中的溶质的质量分数为7.5%.
点评 本题考查溶液浓度计算,涉及物质的量浓度、质量分数质量与物质的量的关系等,难度不大.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
18.下列各组性质比较中,正确的是( )
①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
①沸点:HF>HCl>HBr>HI
②离子还原性:S2->Cl->Br->I-
③酸性:HClO4>HBrO4>HIO4
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2->F->Na+>Mg2+.
| A. | ①②③ | B. | ③④⑤⑥ | C. | ②③④ | D. | ①③④⑤⑥ |
19.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
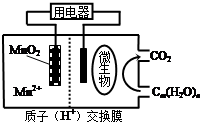

| A. | 分子组成为Cm (H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2 O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm (H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g |
16.已知N2、CO2的混合气体的质量共9.6克,标准状况下,体积为6.72L,则该混合气体中N2和CO2的体积比为( )
| A. | 3:1 | B. | 1:3 | C. | 2:3 | D. | 1:2 |
3.1gH2中含有原子数目( )
| A. | 0.5 mol | B. | 1 mol | C. | 1.5 mol | D. | 2 mol |
13.下列溶液加热蒸干、灼烧后,能析出原溶质固体的是( )
| A. | AlCl3 | B. | KHCO3 | C. | Fe2(SO4)3 | D. | NH4HCO3 |
20.现有以下5种说法:①胶体带电是电泳的前提条件;
②盐酸和食醋既是化合物又是酸;
③氯酸、烧碱、纯碱依次分别为酸、碱、盐;
④古代的青铜器、越王勾践宝剑等均是合金;
⑤溶液包括胶体等分散系;
⑥根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O 可知:H3PO3是三元酸.
其中错误的是( )
②盐酸和食醋既是化合物又是酸;
③氯酸、烧碱、纯碱依次分别为酸、碱、盐;
④古代的青铜器、越王勾践宝剑等均是合金;
⑤溶液包括胶体等分散系;
⑥根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O 可知:H3PO3是三元酸.
其中错误的是( )
| A. | ①②⑤⑥ | B. | ①②③④⑤ | C. | ③④ | D. | ②⑤ |
17.下列说法从化学角度分析不正确的是( )
| A. | 在一定条件下可将石墨转化为金刚石 | |
| B. | 绝大多数金属都能与硝酸反应,但不放出氢气 | |
| C. | 制取镁粉时,可将镁蒸气在氮气中冷却 | |
| D. | SO2能使品红溶液褪色,但不能使紫色石蕊溶液褪色 |