��Ŀ����
����Ŀ������IJ����Ǻ���һ�����һ���ˮƽ�ı�־��2004���ҹ����������������λ�������һ��![]() �ǹ�ҵ���������Ҫ��Ӧ���ڴ����������£�������ܱ������г���
�ǹ�ҵ���������Ҫ��Ӧ���ڴ����������£�������ܱ������г���![]() ��
��![]() �����
�����![]() Ũ�ȣ�c����ʱ�䣨t���ı仯��ϵ��ͼ��ʾ��
Ũ�ȣ�c����ʱ�䣨t���ı仯��ϵ��ͼ��ʾ��
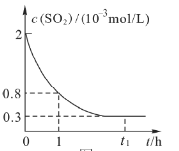
��1����0��1h��Сʱ���ڣ���![]() Ũ�ȱ仯��ʾ�÷�Ӧ��ƽ��������____________
Ũ�ȱ仯��ʾ�÷�Ӧ��ƽ��������____________
A.![]() B.
B.![]()
C.![]() D.
D.![]()
��2��Ϊ�ӿ�÷�Ӧ�����ʣ����д�ʩ���е���___________
A.�����¶�B.ʹ�ø���Ч�Ĵ���
C.��С![]() ��Ũ��D.��С
��Ũ��D.��С![]() ��Ũ�ȣ�
��Ũ�ȣ�
��3������![]() ʱ�̵ķ�Ӧ��ϵ������˵����ȷ����____________
ʱ�̵ķ�Ӧ��ϵ������˵����ȷ����____________
A.��Ӧ��ȫֹͣB.![]() ����ȫת��Ϊ
����ȫת��Ϊ![]()
C.��Ӧδ�ﵽƽ��״̬D.![]() ��Ũ�Ⱦ����ٱ仯
��Ũ�Ⱦ����ٱ仯
���𰸡�
��1��A
��2��B
��3��D
��������
���ݷ�Ӧ���ʱ���ʽ���м��㣻����Ӱ�췴Ӧ���ʵ����ط�����𣻸���ƽ��״̬�Ľ����������������
��1������ͼʾ��Ϣ֪��![]() ���ʴ�Ϊ��A��
���ʴ�Ϊ��A��
��2��A. �����¶ȣ���Ӧ���ʼ�������A����
B. ʹ�ø���Ч�Ĵ�������Ӧ���ʼӿ죬��B��ȷ��
C. ��С![]() ��Ũ�ȣ���Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�������C����
��Ũ�ȣ���Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�������C����
D. ��С![]() ��Ũ�ȣ���Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�������D���ʴ�Ϊ��B��
��Ũ�ȣ���Ӧ��Ũ�Ƚ��ͣ���Ӧ���ʼ�������D���ʴ�Ϊ��B��
��3��A. ![]() ʱ��ʱ�����������Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ��״̬������Ӧ��δֹͣ����A����
ʱ��ʱ�����������Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ��״̬������Ӧ��δֹͣ����A����
B. �ﵽƽ��ʱ����Ȼ���ڶ�������˵��![]() û��ȫת��Ϊ
û��ȫת��Ϊ![]() ����B����
����B����
C. ![]() ʱ��ʱ�����������Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ��״̬����C����
ʱ��ʱ�����������Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ��״̬����C����
D. �ﵽƽ��ʱ��![]() ��Ũ�Ⱦ����ٱ仯����D��ȷ��
��Ũ�Ⱦ����ٱ仯����D��ȷ��
�ʴ�ΪD��

 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�����Ŀ����������һ����Ҫ�Ļ���ԭ�ϡ�ʵ���Һϳɱ������ԭ����װ��ʾ��ͼ(���ȡ� �гּ���������ʡ��)��һЩ�����Ϣ���£�

���� | ��״ | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g/mL�� | �ܽ��� | |
ˮ | �Ҵ� | |||||
�ױ� | ��ɫҺ����ȼ�ӷ� | ��95 | 110.6 | 0.8669 | ���� | ���� |
������ | ��ɫƬ״����״���� | 112.4��100������������ | 248 | 1.2659 | �� | ���� |
��������ˮ�е��ܽ�������
�¶�/�� | 4 | 18 | 75 |
�ܽ��/g | 0.2 | 0.3 | 2.2 |
ijѧϰС����ʵ�����Ʊ������롢�ᴿ�����ᣬ���ⶨ������Ʒ�Ĵ��ȣ��������£�
��.��b �м��� 2.7 mL �ױ���100 mLˮ�ͼ�Ƭ���Ƭ�������綯��������a��ͨˮ����b �е�Һ����������ڣ��������� 8.5 g ������أ���������Լ5 h��ֹͣ���Ⱥͽ��裬���á�
��.�ڷ�Ӧ������м���һ��������(H2C2O4)��ַ�Ӧ�����ˡ�ϴ�ӣ�����Һ���ڱ�ˮԡ����ȴ������Ũ�����ữ��������ȫ���������ѹ���ˣ���ˮϴ�ӣ�����õ��ֲ�Ʒ��
��.��ȡm g��Ʒ����� 100 mL�Ҵ���Һ����ȡ25.00 mL��Һ����ƿ���μ�2��3�η�̪��Ȼ���ñ�Ũ��KOH��Һ�ζ�����ش��������⣺
(1)װ��a������___________
(2)�����ᴿ�����м���IJ�����һ�ֶ�Ԫ���ᣬ��Ӧ����������ʽ�κ���ɫ�������ɡ�������������_______���������ӷ�ʽ��ʾ�÷�Ӧԭ��_____��
(3)��Ʒ��ѹ����ʱ����ˮϴ�ӵ�ԭ����_____________
(4)ѡ������________(ѡ����ĸ)���������Խ��ֲ�Ʒ��һ���ᴿ��
A ����ˮ����� B �����Ҵ�������
C �üױ���ȡ���Һ D ����
(5)�ⶨ���Ȳ����У��ζ��յ���Һ����ɫ�仯��__����m��1.200 g���ζ�ʱ��ȥ0.1200 mol��L��1 ��KOH��Һ20.00 mL�������ò�Ʒ�б��������������Ϊ______��
����Ŀ��2019��ŵ������ѧ����������ӵ�صķ����ߣ�LiFePO4������ӵ�ص��������ϡ��ú�﮷�������Ҫ����Ԫ�صĺ�����Li 8.50%��Ni 6.55%��Mg 13.24%���Ʊ�Li2C2O4���������Ʊ�LiFePO4���ֹ���������ͼ�������̿������ˮ������Ⱦ����
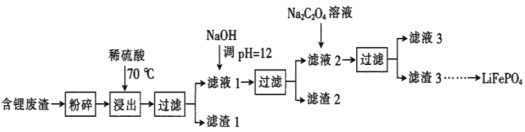
��֪����Һ1����Һ2�в������ӵ�Ũ�ȣ�g��L-1����
Li+ | Ni2+ | Mg2+ | |
��Һ1 | 22.72 | 20.68 | 60.18 |
��Һ2 | 21.94 | 7.7��10-3 | 0.78��10-3 |
I.�Ʊ�Li2C2O4
(1)����2����Ҫ�ɷ���__���ѧʽ����
(2)Na2C2O4��Һ�и����ӵ�Ũ���ɴ�С˳��Ϊ__��
(3)д������Na2C2O4��Һʱ������Ӧ�����ӷ���ʽ��__��
��.�Ʊ�LiFePO4
(4)����ؼ�Li2C2O4��FePO4���ڸ����·�Ӧ����LiFePO4��һ���������壬�÷�Ӧ�Ļ�ѧ����ʽ��___��
(5)LiFePO4��Ҫ�ڸ����³��ͺ������Ϊ�缫�����³���ʱҪ��������ʯī����ʯī��������__����дһ�㣩��
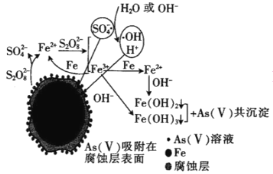
(6)�ҹ���ѧ���о��������������ƣ�Na2S2O8��ȥ����ˮ�е�As(��)�������ģ����ͼ�������������������Ʒ�Ӧ�����ӷ���ʽ��__���ڸ�ģ���еõ������鹲�����ᆳ���գ���Ԫ�ػ��ϼ۱仯����õ�һ�ִ��Ի������ѧʽΪFe7As2O14���������ж��������������ĸ�����Ϊ__��