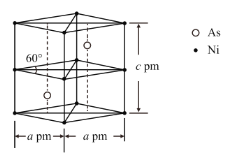
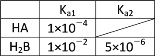题目内容
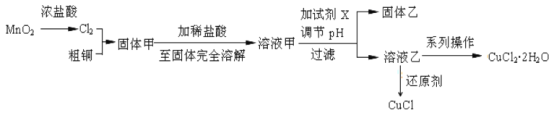
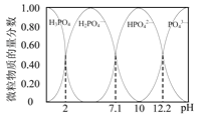
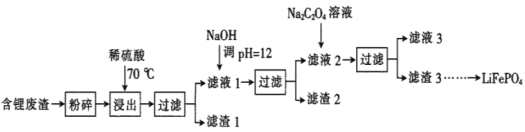
【题目】2019年诺贝尔化学奖授予锂离子电池的发明者,LiFePO4是锂离子电池的正极材料。用含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)制备Li2C2O4,并用其制备LiFePO4部分工艺流程如图(该流程可能造成水体砷污染):
已知:滤液1、滤液2中部分离子的浓度(g·L-1):
Li+ | Ni2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.78×10-3 |
I.制备Li2C2O4
(1)滤渣2的主要成分有__(填化学式)。
(2)Na2C2O4溶液中各离子的浓度由大到小顺序为__。
(3)写出加入Na2C2O4溶液时发生反应的离子方程式:__。
Ⅱ.制备LiFePO4
(4)将电池极Li2C2O4和FePO4置于高温下反应生成LiFePO4和一种温室气体,该反应的化学方程式是___。
(5)LiFePO4需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是__(任写一点)。
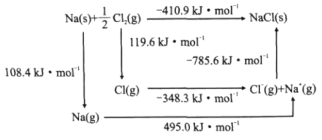
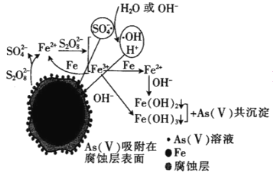
(6)我国科学家研究零价铁活化过硫酸钠(Na2S2O8)去除废水中的As(Ⅴ),其机制模型如图,其中零价铁与过硫酸钠反应的离子方程式是__。在该模型中得到的铁砷共沉淀物经灼烧(无元素化合价变化)后得到一种磁性化合物,化学式为Fe7As2O14,该物质中二价铁与三价铁的个数比为__。
【答案】Mg(OH)2、Ni(OH)2 c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) 2Li++C2O42-=Li2C2O4↓ Li2C2O4+2FePO4![]() 2LiFePO4+2CO2↑ 改善成型后LiFePO4(或电极)的导电作用 Fe+S2O82-=Fe2++2SO42- 3:4
2LiFePO4+2CO2↑ 改善成型后LiFePO4(或电极)的导电作用 Fe+S2O82-=Fe2++2SO42- 3:4
【解析】
含锂废渣(主要金属元素的含量:Li 8.50%、Ni 6.55%、Mg 13.24%)粉碎后加入稀硫酸,并加热,Li、Ni、Mg溶解生成Li2SO4、NiSO4、MgSO4,过滤出不溶物(滤渣1),所得滤液1的主要成分为Li2SO4、NiSO4、MgSO4;加入NaOH调节溶液的pH=12,据表中数据,此时主要发生NiSO4、MgSO4与NaOH的反应,所得滤渣2的主要成分为Ni(OH)2、Mg(OH)2,滤液2中主要含有Li2SO4;加入Na2C2O4,与Li2SO4发生反应,主要生成Li2C2O4沉淀,这就是滤渣3的主要成分。
(1)由以上分析知,滤渣2的主要成分有Mg(OH)2、Ni(OH)2。答案为:Mg(OH)2、Ni(OH)2;
(2)Na2C2O4溶液中,主要存在以下平衡:C2O42-+H2O![]() HC2O4-+OH-、HC2O4-+H2O
HC2O4-+OH-、HC2O4-+H2O![]() H2C2O4+OH-、H2O
H2C2O4+OH-、H2O![]() H++OH-,且程度依次减弱,所以各离子的浓度由大到小顺序为c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)。答案为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
H++OH-,且程度依次减弱,所以各离子的浓度由大到小顺序为c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)。答案为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(3)加入Na2C2O4溶液时,与Li2SO4发生反应,主要生成Li2C2O4沉淀,发生反应的离子方程式为:2Li++C2O42-=Li2C2O4↓。答案为:2Li++C2O42-=Li2C2O4↓;
(4)将Li2C2O4和FePO4置于高温下反应生成LiFePO4和CO2,该反应的化学方程式是Li2C2O4+2FePO4![]() 2LiFePO4+2CO2↑。答案为:Li2C2O4+2FePO4
2LiFePO4+2CO2↑。答案为:Li2C2O4+2FePO4![]() 2LiFePO4+2CO2↑;
2LiFePO4+2CO2↑;
(5)LiFePO4需要在高温下成型后才能作为电极,为增强电极的导电能力,高温成型时要加入少量石墨,则石墨的作用是改善成型后LiFePO4(或电极)的导电作用。答案为:改善成型后LiFePO4(或电极)的导电作用;
(6)零价铁与过硫酸钠反应,生成Fe2+和SO42-,反应的离子方程式是Fe+S2O82-=Fe2++2SO4

【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
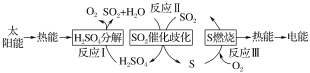
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH=-297kJ·mol-1
反应Ⅱ的热化学方程式:__。
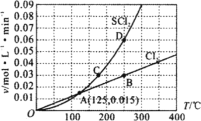
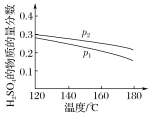
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2__p1(填“>”或“<”),得出该结论的理由是__。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+__=__+__+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4mol·L-1KI | amol·L-1KI 0.2mol·L-1H2SO4 | 0.2mol·L-1H2SO4 | 0.2mol·L-1KI 0.0002molI2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__。
②比较A、B、C,可得出的结论是__。
③实验表明,SO2的歧化反应速率D>A。结合i、ii反应速率解释原因:___。