题目内容
4.设NA为阿伏加德罗常数的数值,下列说法中,正确的是( )| A. | 22.4 L Cl2完全溶于氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,1 L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| C. | 标准状况下,2.24 L NH3中含有共价键的数目为0.3NA | |
| D. | 常温下,22.4 L NO2和N2O4的混合气体中含有NA个氧原子 |
分析 A、气体体积,温度压强不知不能计算物质的量;
B、依据溶液浓度和氢离子浓度计算分析;
C、标准状况下,2.24 L NH3物质的量为0.1mol,结合氨气分子式计算共价键数;
D、常温下,22.4 L NO2和N2O4的混合气体物质的量不是1mol.
解答 解:A、气体体积,温度压强不知不能计算物质的量,故A错误;
B、1 L pH=1的H2SO4溶液中含有的H+的数目=1L×0.1mol/L×NA=0.1NA,故B错误;
C、标准状况下,2.24 L NH3物质的量为0.1mol,结合氨气分子式计算共价键数=0.3NA,故C正确;
D、常温下,22.4 L NO2和N2O4的混合气体物质的量不是1mol,22.4 L NO2和N2O4的混合气体中含有氧原子不是NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的体积应用分析,氧化还原反应电子转移的计算,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.高纯度晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.它可以按下列方法制备:SiO2 $→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000℃--1100℃}^{③过量H_{2}}$Si(纯),下列说法正确的是( )
| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移4mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
15.甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)
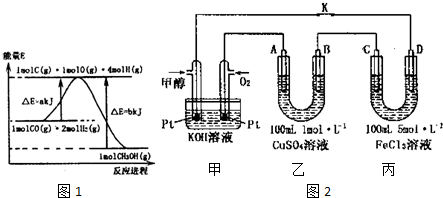
(1)合成甲醇的反应过程中物质能量变化如图1所示.写出合成甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol.
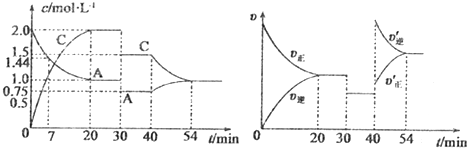
(2)实验室在lL密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L-l)
①300℃时反应开始10分钟内,H2的平均反应速率为0.08mol/(L•min);
②500℃时平衡常数K的数值为25;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是cd(选填编号).
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
(3)如图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①甲中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中A极析出的气体在标准状况下的体积为2.24l;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要300mL5.0mol•L-lNaOH 溶液.

(1)合成甲醇的反应过程中物质能量变化如图1所示.写出合成甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol.
(2)实验室在lL密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L-l)
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
②500℃时平衡常数K的数值为25;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是cd(选填编号).
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
(3)如图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①甲中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中A极析出的气体在标准状况下的体积为2.24l;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要300mL5.0mol•L-lNaOH 溶液.
9.有机物C5H10Cl2的结构中只含有一个甲基的同分异构体有几种(不考虑立体异构)( )
| A. | 4 | B. | 6 | C. | 10 | D. | 18 |
16.下列关于金属的说法中,正确的是( )
| A. | 篮球架的表面喷涂油漆,主要是为了美观 | |
| B. | 回收金属饮料罐,只是为了减少环境污染 | |
| C. | 银的导电性比铜好,所以常用银作电线而不用铜 | |
| D. | 不锈钢抗腐蚀性好,常用于制医疗器械、炊具等 |
13.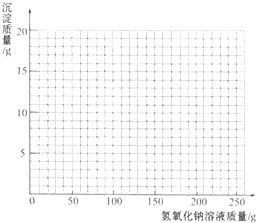 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为9.8g,该混合溶液中硫酸铜的质量为16g.
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
14.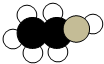 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )| A. | 能使紫色石蕊变红 | B. | 能与Na2CO3反应 | ||
| C. | 能发生酯化反应 | D. | 不能发生氧化反应 |
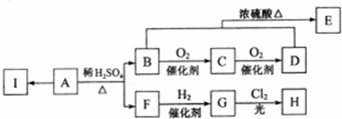
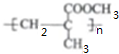 .
.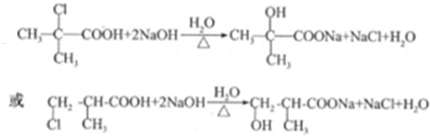 (任写一个)
(任写一个)