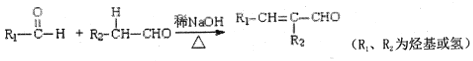题目内容
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是__________。
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3) 根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4的结构如图所示
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________。
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) ΔH= -1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________。
【答案】 M △H1+△H2/2+△H3/2 -1940 kJ·mol-1 2Cl2(g)+2H2O(g)+C(s) ===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1 98 kJ
【解析】(1)有机物M经过太阳光光照可转化成N的关系时吸收能量,则N的能量高,比M活泼,较稳定的化合物为M;
(2)根据盖斯定律,反应①+②/2+③/2得:C(s)+O2(g)=2CO2(g),所以C(s)的燃烧热△H=△H1+△H2/2+△H3/2
(3) △H=反应物的键能之和-生成物的键能之和,结合图表中键能数据和反应中化学键的判断计算,△H= 414 kJ·mol-1![]() 4+155 kJ·mol-1
4+155 kJ·mol-1![]() 4-(489 kJ·mol-1
4-(489 kJ·mol-1![]() 4+565 kJ·mol-1
4+565 kJ·mol-1![]() 4)=-1940 kJ·mol-1
4)=-1940 kJ·mol-1
(4)有1 mol Cl2参与反应时释放出145 kJ热量,2 mol Cl2参与反应时释放出290 kJ热量,反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s) ===4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1
(5)![]() ,转移12mol电子放出1176kJ热量,则反应过程中,每转移1 mol电子放出的热量为
,转移12mol电子放出1176kJ热量,则反应过程中,每转移1 mol电子放出的热量为![]() =98kJ。
=98kJ。

【题目】实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体;可溶于水。
(1)制备Na2S2O5(夹持装置略)

① A为SO2发生装置,A中反应方程式是_____________________________________。
② B 中析出白色晶体,可采取的分离方法是___________________。
③ 将尾气处理装置C补充完整并标明所用试剂。___________________
(2) 探究Na2S2O5的性质
实验编号 | 实验操作及现象 |
实验Ⅰ | 取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性。 |
实验Ⅱ | 取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解。 |
实验III | 取B中少量白色晶体于试管中,滴加1mL 2 mol / L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 。 |
实验IV | 取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复。 |
① 由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因_______________________________________(用化学方程式表示) 。
② 实验Ⅱ中白色沉淀滴加过量盐酸,沉淀溶解,用平衡原理解释原因______________________。
③ 实验III中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________。
④ 实验IV 中产生的气体为____________,实验中利用该气体的_________ 性质进行检验。
⑤ 从上述实验探究中,体现出Na2S2O5具有 _____________________性质。 ( 至少说出两点 )。