题目内容
【题目】下表为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 _________ mol/L;
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.400mol/L的稀盐酸,
①该学生需要量取__________ mL上述浓盐酸进行配制;
②所需玻璃仪器有:玻璃棒、烧杯、量筒、__________ 、__________ ;
③在配制过程中,下列实验操作会导致所配制的稀盐酸的物质的量浓度偏高的有__________ 。
A.定容时,俯视容量瓶刻度线进行定容;
B.在烧杯中将浓盐酸进行稀释后立即转入容量瓶;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水;
E.定容摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线。
【答案】11.9 16.8 500mL容量瓶 胶头滴管 AB
【解析】
依据c=![]() 计算浓盐酸物质的量浓度;
计算浓盐酸物质的量浓度;
(2)①依据溶液稀释过程中所含溶质的物质的量保持不变计算需要浓盐酸体积;
②根据配制物质的量浓度的溶液的步骤确定使用的仪器,然后结合实验用到的基本仪器已有烧杯、玻璃棒、量筒,可知缺少的仪器有500ml容量瓶、胶头滴管;
③分析操作对溶质的物质的量和溶液体积的影响,依据c=![]() 进行误差分析。
进行误差分析。
(1)根据物质的量浓度与质量分数的换算式可知该浓盐酸中HCl的物质的量浓度c=![]() mol/L=11.9mol/L;
mol/L=11.9mol/L;
(2)①实验室没有规格是480mL的容量瓶,根据选择仪器的标准是“大而近”的原则,选择使用500mL的容量瓶。由于溶液在稀释前后溶质的物质的量不变,设需要浓盐酸体积为V,可得V×11.9mol/L=0.400molL-1×500mL,解得V=16.8mL;
②实验用到的基本仪器已有烧杯、玻璃棒、量筒,胶头滴管,500ml容量瓶;所以差500ml容量瓶、胶头滴管;
③A.定容时,俯视容量瓶刻度线进行定容,则溶液的体积偏小,根据c=![]() 可知V偏小,则配制的溶液的浓度偏高,A符合题意;
可知V偏小,则配制的溶液的浓度偏高,A符合题意;
B.浓盐酸溶于水放出热量,在烧杯中将浓盐酸进行稀释后立即转入容量瓶,由于溶液温度高于室温,当溶液恢复至室温后,溶液的液面低于刻度线,使V偏小,则根据c=![]() 可知V偏小,则配制的溶液的浓度偏高,B符合题意;
可知V偏小,则配制的溶液的浓度偏高,B符合题意;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面,导致溶质的物质的量减少,根据c=![]() 可知n偏小,则配制的溶液的浓度偏低,C不符合题意;;
可知n偏小,则配制的溶液的浓度偏低,C不符合题意;;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,由于不影响溶质的物质的量和溶液的体积,因此对配制的溶液的浓度无影响,D不符合题意;
E.定容摇匀后,由于一部分溶液粘在容量瓶的瓶颈上,使溶液的液面低于刻度线,但若再加蒸馏水至刻度线,会对原来配制的溶液起稀释作用,导致溶液的浓度偏低,E不符合题意;
故合理选项是AB。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是__________。
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
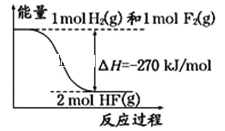
(3) 根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4的结构如图所示
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________。
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) ΔH= -1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________。