题目内容
【题目】实验小组制备焦亚硫酸钠(Na2S2O5)并探究其性质。
资料:焦亚硫酸钠为白色晶体;可溶于水。
(1)制备Na2S2O5(夹持装置略)

① A为SO2发生装置,A中反应方程式是_____________________________________。
② B 中析出白色晶体,可采取的分离方法是___________________。
③ 将尾气处理装置C补充完整并标明所用试剂。___________________
(2) 探究Na2S2O5的性质
实验编号 | 实验操作及现象 |
实验Ⅰ | 取B中少量白色晶体于试管中,加入适量蒸馏水,得溶液a,测得溶液呈酸性。 |
实验Ⅱ | 取少量溶液a于试管中,滴加足量氢氧化钡溶液,有白色沉淀生成,过滤后,将沉淀放入试管中,滴加过量盐酸,充分振荡,产生气泡,白色沉淀溶解。 |
实验III | 取B中少量白色晶体于试管中,滴加1mL 2 mol / L酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 。 |
实验IV | 取B中少量白色晶体于大试管中加热,将产生的气体通入品红溶液中,红色褪去;将褪色后的溶液加热,红色恢复。 |
① 由实验Ⅰ可知,Na2S2O5溶于水,溶液呈酸性的原因_______________________________________(用化学方程式表示) 。
② 实验Ⅱ中白色沉淀滴加过量盐酸,沉淀溶解,用平衡原理解释原因______________________。
③ 实验III中经测定溶液中产生Mn2+,该反应的离子方程式是_________________________。
④ 实验IV 中产生的气体为____________,实验中利用该气体的_________ 性质进行检验。
⑤ 从上述实验探究中,体现出Na2S2O5具有 _____________________性质。 ( 至少说出两点 )。
【答案】Na2SO3 + H2SO4 == Na2SO4 + SO2 ↑ + H2O 过滤 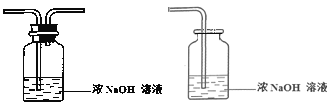 Na2S2O5 + H2O === NaHSO3 HSO3
Na2S2O5 + H2O === NaHSO3 HSO3![]() H+ + SO32- BaSO3存在平衡:BaSO3 (s)
H+ + SO32- BaSO3存在平衡:BaSO3 (s) ![]() Ba2+(aq) + SO32-(aq) 加入盐酸,SO32- + H+ === HSO3- + OH-,HSO3- + H+ === SO2+ H2O;平衡右移,沉淀溶解 5 S2O52- + 4 MnO4 - + 2H+ === 10 SO42- + 4 Mn2+ + H2O SO2 漂白性 体现出Na2S2O5具有还原性、不稳定性、盐的通性
Ba2+(aq) + SO32-(aq) 加入盐酸,SO32- + H+ === HSO3- + OH-,HSO3- + H+ === SO2+ H2O;平衡右移,沉淀溶解 5 S2O52- + 4 MnO4 - + 2H+ === 10 SO42- + 4 Mn2+ + H2O SO2 漂白性 体现出Na2S2O5具有还原性、不稳定性、盐的通性
【解析】
本题为实验探究题,探究焦亚硫酸钠的性质。
(1)①二氧化硫的制备可采用较强酸制较弱酸的方法,用亚硫酸钠与浓硫酸制备,反应方程式为Na2SO3 + H2SO4 == Na2SO4 + SO2 ↑ + H2O;
②难溶物与液体进行分离时可采用过滤方法;
③尾气的处理方法很多,可用液体试剂,也可用固体试剂。用液体试剂一般用集气瓶盛装,采用长进短出的连接方式,用固体试剂一般用U型管,二氧化硫可采用前一种试剂和装置;
(2)①②③④四组实验主要探究的是焦亚硫酸钠的性质,焦亚硫酸钠具有还原性、不稳定性、盐的通性;
(1)①根据较强酸制较弱酸原理,可利用亚硫酸钠与浓硫酸制备二氧化硫,反应方程式为Na2SO3 + H2SO4 == Na2SO4 + SO2 ↑ + H2O。本小题答案为:Na2SO3 + H2SO4 == Na2SO4 + SO2 ↑ + H2O。
②难溶物与液体进行分离可采用过滤的方法,则B 中析出白色晶体,分离方法是过滤。本小题答案为:过滤。
③尾气为二氧化硫,可用浓的氢氧化钠溶液吸收,装置可采用集气瓶、双孔塞,导管连接方式为长进短出。本小题答案为: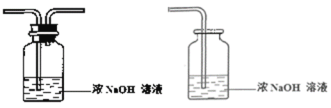 。
。
(2)① 由实验Ⅰ可知,Na2S2O5溶于水,先水解Na2S2O5 + H2O === NaHSO3,亚硫酸氢钠再电离HSO3![]() H+ + SO32-,溶液显酸性。本小题答案为:Na2S2O5 + H2O === NaHSO3 HSO3
H+ + SO32-,溶液显酸性。本小题答案为:Na2S2O5 + H2O === NaHSO3 HSO3 ![]() H+ + SO32-。
H+ + SO32-。
② 实验Ⅱ中白色沉淀滴加过量盐酸,沉淀溶解,BaSO3存在平衡:BaSO3 (s) ![]() Ba2+(aq) + SO32-(aq) 加入盐酸,SO32- + H+ === HSO3- + OH-,HSO3- + H+ === SO2+ H2O;平衡右移,沉淀溶解。本小题答案为:BaSO3存在平衡:BaSO3 (s)
Ba2+(aq) + SO32-(aq) 加入盐酸,SO32- + H+ === HSO3- + OH-,HSO3- + H+ === SO2+ H2O;平衡右移,沉淀溶解。本小题答案为:BaSO3存在平衡:BaSO3 (s) ![]() Ba2+(aq) + SO32-(aq) 加入盐酸,SO32- + H+ === HSO3- + OH-,HSO3- + H+ === SO2+ H2O;平衡右移,沉淀溶解。
Ba2+(aq) + SO32-(aq) 加入盐酸,SO32- + H+ === HSO3- + OH-,HSO3- + H+ === SO2+ H2O;平衡右移,沉淀溶解。
③实验III中经测定溶液中产生Mn2+,Na2S2O5与高锰酸钾发生了氧化还原反应,Na2S2O5中硫元素化合价由+4价升高到+6价发生氧化反应,Na2S2O
④根据实验IV中的现象可知Na2S2O5受热易分解,产生的气体为二氧化硫气体,利用的是二氧化硫的漂白性。本小题答案为:SO2;漂白性。
⑤从上述实验探究中,体现出Na2S2O5具有还原性、不稳定性、盐的通性。本小题答案为:
还原性、不稳定性、盐的通性。

【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是__________。
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3) 根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4的结构如图所示
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________。
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) ΔH= -1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________。
【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。







