题目内容
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+)________(填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+).
(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.

①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是__,导致pH随温度变化的原因是___________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______.
(4)室温时,向100mL0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是________.
【答案】(每空2分,共14分)(1)Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O![]() Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 (2)小于
Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 (2)小于
(3)①Ⅰ NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小
②(10-3-10-11)mol·L-1 (4)a c(Na+)>c(SO42-)>c(NH4+))>c(OH-)=c(H+)
【解析】
(1)Al3+水解生成的Al(OH)3胶体,具有吸附性,离子方程式:Al3++3H2O═Al(OH)3胶体+3H+;
(2)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 molL-1[c(OH-)太小,可忽略];
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。

【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。

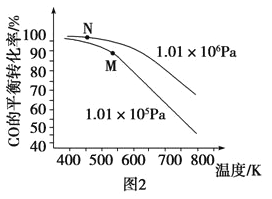
①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是__________。
(2)根据下列热化学方程式分析,C(s)的燃烧热△H等于_____________ (用△H1 、△H2、△H3表示)
C(s)+H2O(l)=CO(g)+H2(g); △H1
2CO(g)+O2(g)=2CO2(g); △H2
2H2(g)+O2(g)=2H2O(l); △H3
(3) 根据键能数据估算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=________。
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4的结构如图所示
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________________________。
(5)将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) ΔH= -1176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_____________。