题目内容
19.在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下: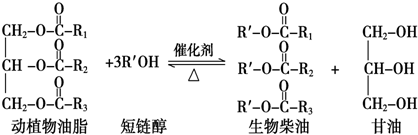
下列叙述错误的是( )
| A. | 生物柴油由可再生资源制得 | B. | 生物柴油是不同酯组成的混合物 | ||
| C. | 动植物油脂是高分子化合物 | D. | “地沟油”可用于制备生物柴油 |
分析 A.生物柴油其原料取自可再生的动植物资源;
B.生物柴油通常是指以动植物油脂为原料生产的、以脂肪酸甲酯为主要成份的液体燃料;
C.相对分子质量在10000以上的有机化合物为高分子化合物;
D.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油.
解答 解:A.生物柴油由可再生资源制得,故A正确;
B.生物柴油通常是指以动植物油脂为原料生产的、以不同脂肪酸甲酯组成的混合物,故B正确;
C.动植物油脂是高分子化合物相对分子质量小于10000,不是高分子化合物,故C错误;
D.“地沟油”中含有动植物油脂,动植物油脂与醇反应可制备生物柴油,故D正确;
故选C.
点评 本题主要考查了油脂的性质与用途,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
10.某元素X的最高价氧化物的化学式为X2O5,则它的气态氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH5 |
7.实验测得CO2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是( )
| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | CO2中C采取sp2杂化 |
14.如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
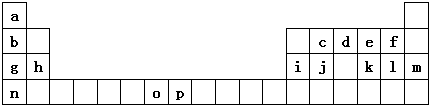
试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.

试回答下列问题:
(1)元素p的原子的电子占有7种能量不同的原子轨道.
(2)e、f、g、h四种元素形成的离子半径由大到小顺序为O2->F->Na+>Mg2+(用离子符号表示)
(3)单质d与单质a反应的产物的分子中中心原子的杂化形式为sp3,该分子是极性(填“极性”或“非极性”)分子.
(4)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量.
(5)o、p两元素的部分电离能数据列于下表:
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(6)a、d、e可以形成一种盐,此盐的组成中a、d、e元素的原子个数比为4:2:3,此盐的化学式为NH4NO3,含有的化学键为离子键、共价键、配位键.
4.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |
11.下列哪组离子能在水溶液中大量共存( )
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
 ;
; 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;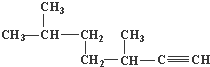 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
;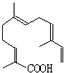 所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应.
所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应. 中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基. .
.