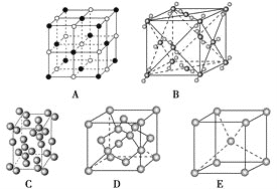
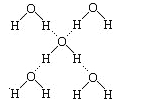
题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中:Fe2+、NO3﹣、Na+、SO42﹣
B. 水电离出的c(H+)=10﹣12mol/L的溶液中:Ca2+、K+、Cl﹣、HCO3﹣
C. c(H+)/c(OH—)=1012的水溶液中:NH4+、Al3+、NO3﹣、Cl﹣
D. c(Fe3+)=0.1mol/L的溶液中:K+、ClO﹣、SO42﹣、SCN-
【答案】C
【解析】
A. pH=1的溶液显酸性,Fe2+、NO3﹣之间发生氧化还原反应,不能大量共存,A错误;B. 水电离出的c(H+)=10﹣12mol/L的溶液可能显酸性,也可能显碱性,HCO3﹣与氢离子或氢氧根均不能大量共存,B错误;C. ![]() =1012的水溶液显酸性:NH4+、Al3+、NO3﹣、Cl﹣之间不反应,可以大量共存,C正确;D. c(Fe3+)=0.1mol/L的溶液中SCN﹣不能大量共存,D错误,答案选C。
=1012的水溶液显酸性:NH4+、Al3+、NO3﹣、Cl﹣之间不反应,可以大量共存,C正确;D. c(Fe3+)=0.1mol/L的溶液中SCN﹣不能大量共存,D错误,答案选C。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等