题目内容
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
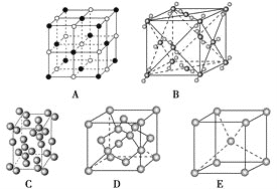
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
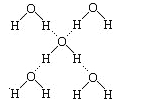
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
【答案】E C D B A BC 20
【解析】
由晶胞图可知,A为氯化钠的晶胞图,构成微粒为离子;B为干冰的晶胞图,构成微粒为二氧化碳分子;C为碘的晶胞图,构成微粒为碘分子;D为金刚石的晶胞图,构成微粒为碳原子;E为钠的晶胞图,构成微粒为原子。
(1)由分析可知,A为氯化钠的晶胞图,B为干冰的晶胞图,C为碘的晶胞图,D为金刚石的晶胞图,E为钠的晶胞图;
(2) 金刚石属于原子晶体、氯化钠属于离子晶体,钠是金属晶体,碘和干冰属于分子晶体。冰属于分子晶体,故与冰的晶体类型相同的是BC;
(3) 每个水分子与相邻的4个水分子形成氢键,每个氢键属于水分子的1/2,所以1mol冰晶体中含有2mol氢键,冰吸收热量升华,成为水蒸气,需要克服2mol氢键和范德华力,设氢键的“键能”是x,所以51kJ/mol=11kJ/mol+2x,解得x=20kJ/mol。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为___,该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
